Đề thi Hóa Học 12 giữa kì 2 có đáp án
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 4)
-
2929 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 1:
21/07/2024Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì dùng chất nào sau đây để khử độc thủy ngân?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
S tác dụng với Hg ngay ở nhiệt độ thường.
Dùng bột S để khử độc Hg nếu chẳng may nhiệt kế thủy ngân bị vỡ.
Hg + S HgS.
Câu 2:
23/07/2024Kim loại nào sau đây vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Kim loại Al vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH.
Phương trình hóa học:
2Al + 6HCl 2AlCl3 + 3H2
Al + NaOH + H2O NaAlO2 + H2
Câu 3:
18/07/2024Khử hoàn toàn 24 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Phương trình hóa học: CuO + CO Cu + CO2.
nCu = nCuO = 0,3 (mol).
m = mCu = 0,3×64 = 19,2 (gam).
Câu 4:
22/07/2024Cho m gam Al phản ứng hoàn toàn với khí Cl2 dư, thu được 26,7 gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Phương trình hóa học: 2Al + 3Cl2 2AlCl3.
nAl = = 0,2 (mol).
m = mAl = 0,2×27 = 5,4 (gam).
Câu 5:
23/07/2024Hòa tan hoàn toàn 3,9 gam hỗn hợp Al và Mg trong dung dịch H2SO4 dư, thu được 4,48 lít khí H2 và dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Sơ đồ phản ứng: hỗn hợp + H2SO4 Muối + H2.
= 0,2 (mol) = 0,2 (mol).
m = mmuối = m(Al, Mg) + = 3,9 + 0,2×96 = 23,1 (gam).
Câu 6:
20/07/2024Ở nhiệt độ thường, kim loại tồn tại ở trạng thái lỏng là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Ở nhiệt độ thường, kim loại tồn tại ở trạng thái lỏng là Hg.
Câu 7:
19/07/2024Tính chất vật lí nào của kim loại không phải do electron tự do gây ra?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Những tính chất vật lí chung của kim loại (tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim) chủ yếu do các electron tự do trong kim loại gây ra.
Một số tính chất vật lí của kim loại như khối lượng riêng, nhiệt độ nóng chảy, tính cứng phụ thuộc vào độ bền của liên kết kim loại, nguyên tử khối, kiểu mạng tinh thể … của kim loại.
Câu 8:
23/07/2024Cho muối X vào dung dịch NaOH dư, thu được kết tủa màu trắng. Muối X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Muối X là MgSO4.
Phương trình hóa học: MgSO4 + 2NaOH Mg(OH)2¯ + Na2SO4.
Loại B vì: Ban đầu tạo kết tủa trắng keo, sau đó kết tủa tan hoàn toàn trong NaOH dư.
Al2(SO4)3 + 6NaOH 2Al(OH)3¯ + 3Na2SO4
Al(OH)3 + NaOH NaAlO2 + 2H2O
Loại C vì: Tạo kết tủa màu xanh.
CuSO4 + 2NaOH Cu(OH)2¯ + Na2SO4.
Loại D vì: Tạo kết tủa nâu đỏ.
FeCl3 + 3NaOH Fe(OH)3¯ + 3NaCl
Câu 9:
19/07/2024Kim loại nào sau đây không tan trong nước?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Be không tan trong nước ở nhiệt độ thường cũng như nhiệt độ cao.
Loại A, C, D vì: Na, K, Ba tan trong nước ở nhiệt độ thường tạo thành dung dịch bazơ.
2Na + 2H2O 2NaOH + H2
2K + 2H2O 2KOH + H2
Ba + 2H2O Ba(OH)2 + H2
Câu 10:
19/07/2024Nung hợp chất X trong không khí đến khối lượng không đổi, thu được Fe2O3 và H2O. Cho X vào dung dịch HNO3 đặc, nóng, có khí thoát ra. Hợp chất X là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Cho X vào dung dịch HNO3 đặc, nóng, có khí thoát ra.
X là hiđroxit sắt(II): Fe(OH)2.
Phương trình hóa học:
4Fe(OH)2 + O2 2Fe2O3 + 4H2O
Fe(OH)2 + 4HNO3 Fe(NO3)3 + NO2 + 3H2O
Câu 11:
19/07/2024Chất nào sau đây tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Để tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO thì hợp chất sắt phải có số oxi hóa của Fe ≠ +3.
FeO tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO.
3FeO + 10HNO3 3Fe(NO3)3 + NO + 5H2O
Câu 12:
19/07/2024Tính chất hóa học chung của kim loại là tính
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Tính chất hóa học đặc trưng của kim loại là tính khử.
M Mn+ + ne.
Câu 13:
19/07/2024Thuốc thử để phân biệt các mẫu hóa chất mất nhãn gồm: Na2CO3, HCl, NaHSO4 là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Phân biệt: Na2CO3, HCl, NaHSO4.
Dùng dung dịch Ba(HCO3)2.
+ Thấy có khí thoát ra là HCl.
Ba(HCO3)2 + 2HCl BaCl2 + 2CO2 + 2H2O
+ Thấy vừa có khí thoát ra, vừa xuất hiện kết tủa trắng là NaHSO4.
Ba(HCO3)2 + 2NaHSO4 Na2SO4 + BaSO4¯ + 2CO2 + 2H2O
+ Chỉ thấy xuất hiện kết tủa trắng là Na2CO3.
Ba(HCO3)2 + Na2CO3 BaCO3¯ + 2NaHCO3
Câu 14:
19/07/2024Phương trình hóa học nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Phương trình hóa học không đúng: Cu + 2HCl → CuCl2 + H2.
Vì kim loại Cu không phản ứng với dung dịch HCl.
Câu 15:
19/07/2024Phương trình phản ứng nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Phương trình phản ứng đúng: Mg + CuSO4 → MgSO4 + Cu.
Loại B vì: 2Na + 2H2O 2NaOH + H2;
2NaOH + CuSO4 Na2SO4 + Cu(OH)2¯.
Loại C vì: Fe + 2HCl FeCl2 + H2.
Loại D vì: Vì kim loại Cu không phản ứng với dung dịch H2SO4 loãng.
Câu 16:
21/07/2024Kim loại tác dụng với khí Cl2 và dung dịch HCl tạo cùng loại muối là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Kim loại Mg tác dụng với khí Cl2 và dung dịch HCl tạo cùng loại muối.
Mg + Cl2 MgCl2
Mg + 2HCl MgCl2 + H2
Loại A vì: Kim loại Fe tác dụng với khí Cl2 và dung dịch HCl thu được hai muối khác nhau.
2Fe + 3Cl2 2FeCl3
Fe + 2HCl FeCl2 + H2
Loại B vì: Cu không phản ứng với dung dịch HCl.
Loại C vì: Ag không phản ứng với dung dịch HCl.
Câu 17:
19/07/2024Chất nào sau đây không bị khử bởi CO ở nhiệt độ cao?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
CO chỉ khử được oxit của kim loại có tính khử trung bình hoặc yếu như Zn, Cu, Fe, Ni, …
MgO không bị khử bởi CO ở nhiệt độ cao.
Câu 18:
21/07/2024Cho các phát biểu sau:
(a) Các kim loại kiềm thường tồn tại dạng đơn chất trong tự nhiên.
(b) Có thể sử dụng vôi để làm mềm nước có tính cứng tạm thời.
(c) Trong công nghiệp, Al được điều chế từ nguyên liệu là đất sét
(d) Nhúng miếng Al vào dung dịch CuSO4 có xảy ra ăn mòn điện hóa học.
(e) Dùng dung dịch NaOH có thể phân biệt các chất rắn là MgO, Al2O3, Al.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Phát biểu đúng: (b), (d). (e).
Phát biểu (a) không đúng, vì: Kim loại kiềm dễ bị oxi hóa thành ion dương, do vậy trong tự nhiên kim loại kiềm chỉ tồn tại ở dạng hợp chất.
Phát biểu (c) không đúng, vì: Trong công nghiệp, Al được sản xuất từ quặng boxit (thành phần chính là Al2O3.2H2O).
Câu 19:
22/07/2024Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch AgNO3;
(2) Cho Fe vào dung dịch Fe2(SO4)3;
(3) Cho Na vào dung dịch CuSO4;
(4) Dẫn khí CO (dư) qua bột CuO nóng.
Các thí nghiệm không tạo thành kim loại là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
(1) Zn + 2AgNO3 Zn(NO3)2 + 2Ag
(2) Fe + Fe2(SO4)3 3FeSO4
(3) Cho Na vào dung dịch CuSO4:
2Na + 2H2O 2NaOH + H2
2NaOH + CuSO4 Na2SO4 + Cu(OH)2¯
(4) CO + CuO Cu + CO2
Thí nghiệm không tạo thành kim loại là: (2), (3).
Câu 20:
19/07/2024Hấp thụ hết 4,48 lít CO2 đktc vào dung dịch chứa 16g NaOH được dung dịch X. Khối lượng muối tan thu được trong dung dịch X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
= 0,2 (mol); nNaOH = 0,4 (mol).
Nhận xét: = 2 Chỉ tạo muối Na2CO3 (CO2 và NaOH phản ứng vừa đủ).
Phương trình hóa học:
CO2 + 2NaOH Na2CO3 + H2O
0,2 0,4 0,2 (mol)
mmuối = = 0,2×106 = 21,2 (gam).
Câu 21:
19/07/2024Cho các dung dịch loãng: (1) FeCl3, (2) AgNO3, (3) H2SO4 loãng, (4) HCl, (5) hỗn hợp gồm HCl và NaNO3. Những dung dịch phản ứng được với kim loại Cu là:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Những dung dịch phản ứng được với kim loại Cu là: (1), (2), (5).
(1) Cu + 2FeCl3 CuCl2 + 2FeCl2
(2) Cu + 2AgNO3 Cu(NO3)2 + 2Ag
(5) 3Cu + 8H+ + 2 3Cu2+ + 2NO + 4H2O
Câu 22:
23/07/2024Quá trình xảy ra tại các điện cực khi điện phân dung dịch AgNO3 là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Quá trình điện phân:
|
Cực âm (-): Ag+, H2O |
Cực dương (+):, H2O |
|
Ag+ + 1e Ag (Sự khử ion Ag+) |
2H2O O2 + 4H+ + 4e |
Câu 23:
23/07/2024Cho m gam bột Fe tác dụng hoàn toàn với một lượng dư dung dịch CuSO4 thu được 9,6 gam Cu. Giá trị m là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Phương trình hóa học: Fe + CuSO4 FeSO4 + Cu.
nFe = nCu = 0,15 (mol).
m = mFe = 0,15×56 = 8,4 (gam).
Câu 24:
19/07/2024Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở to cao. Sau phản ứng hỗn hợp chất rắn còn lại là:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Sơ đồ phản ứng: Oxit + H2 Rắn + CO2.
Hỗn hợp chất rắn sau phản ứng gồm: Cu, Fe, Zn, MgO.
Câu 25:
22/07/2024Sục khí CO2 dư vào dung dịch Ca(OH)2 sẽ có hiện tượng gì xảy ra?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Sục khí CO2 dư vào dung dịch Ca(OH)2:
Hiện tượng: Xuất hiện kết tủa trắng sau đó kết tủa tan dần.
Phương trình hóa học:
CO2 + Ca(OH)2 CaCO3¯ + H2O
CO2 + CaCO3 + H2O Ca(HCO3)2
Câu 26:
22/07/2024Điện phân đến hết 0,2 mol Cu(NO3)2 trong dung dịch với điện cực trơ, thì sau điện phân khối lượng dung dịch đã giảm bao nhiêu gam?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Quá trình điện phân:
|
Catot (-): Cu2+, H2O |
Anot (+):, H2O |
|
Cu2+ + 2e Cu 0,2 0,4 0,2 (mol) |
2H2O O2 + 4H+ + 4e 0,1 0,4 (mol) |
mdd giảm = mCu + = 0,2×64 + 0,1×32 = 16 (gam).
Câu 27:
22/07/2024Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Zn vào dung dịch AgNO3.
- Thí nghiệm 2: Nhúng thanh Ag vào dung dịch CuSO4.
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3.
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl;
- Thí nghiệm 5: Đốt dây thép (Fe, C) trong khí Cl2.
Số trường hợp xuất hiện ăn mòn điện hóa là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Điều kiện xảy ra ăn mòn điện hóa;
+ Các điện cực phải khác nhau về bản chất.
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
+ Các điện cực cùng tiếp xúc với dung dịch chất điện li.
- Thí nghiệm 1: Nhúng thanh Zn vào dung dịch AgNO3.
Zn + 2AgNO3 Zn (NO3)2 + 2Ag
Hình thành cặp điện cực Zn – Ag Xảy ra sự ăn mòn điện hóa.
- Thí nghiệm 2: Nhúng thanh Ag vào dung dịch CuSO4.
Ag + CuSO4 Không phản ứng
Không xảy ra sự ăn mòn điện hóa.
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3.
Cu + 2FeCl3 CuCl2 + 2FeCl2
Không hình thành cặp điện cực Không xảy ra ăn mòn điện hóa.
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl.
Xuất hiện cặp điện cực Fe – Cu Xảy ra ăn mòn điện hóa.
- Thí nghiệm 5: Đốt dây thép (Fe, C) trong khí Cl2.
Không xảy ra ăn mòn điện hóa vì các điện cực không cùng tiếp xúc với dung dịch chất điện li.
Vậy: Thí nghiệm (1) và thí nghiệm (4) xảy ra ăn mòn điện hóa.
Câu 28:
22/07/2024Hoà tan hoàn toàn 13 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2O (đktc). Khối lượng muối trong dung dịch X là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
nZn = 0,2 (mol); = 0,02 (mol)
Nhận xét: 2nZn = 0,4 ≠ 8 = 0,16 Có muối NH4NO3 trong dung dịch.
Bảo toàn e: 2nZn = 8 + 8 = 0,03 (mol).
mmuối = = 0,2×189 + 0,03×80 = 40,2 (gam).
Câu 29:
19/07/2024Cho 41 gam hỗn hợp bột gồm Zn và Fe vào 500 ml dung dịch CuSO4 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và 43,2 gam hỗn hợp kim loại. Phần trăm khối lượng của Fe trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
= 0,5 (mol).
Tính khử: Zn > Fe Thứ tự kim loại phản ứng với dung dịch CuSO4: Zn, Fe.
Khối lượng kim loại tăng sau phản ứng Fe có tham gia phản ứng với dung dịch CuSO4.
Nếu CuSO4 phản ứng hoàn toàn thì: mCu = 0,5×64 = 32 < 43,2 Kim loại Fe còn dư sau phản ứng.
mFe (dư) = 43,2 – 32 = 11,2 (gam).
Phương trình hóa học:
Zn + CuSO4 ZnSO4 + Cu
x x x (mol)
Fe + CuSO4 FeSO4 + Cu
y y y (mol)
Gọi nZn = x (mol); nFe(pư) = y (mol)
mKL tăng = 64×(x + y) – (65x + 56y) = 43,2 – 41 = 2,2
8y = 2,2 + x (*)
Ta có: 65x + 56y + 11,2 = 41 (**)
Từ (*) và (**), suy ra: x = 0,2; y = 0,3.
%mFe = .
Câu 30:
22/07/2024Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ba(HCO3)2 vào dung dịch KHSO4.
(b) Cho Fe vào dung dịch CuSO4 dư.
(c) Cho dung dịch (NH4)2CO3 vào dung dịch Ba(OH)2.
(d) Cho NaOH tới dư vào dung dịch FeCl3.
(e) Cho dung dịch NaOH vào dung dịch H2SO4.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả chất rắn và khí là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
(a) Ba(HCO3)2 + 2KHSO4 BaSO4¯ + K2SO4 + 2CO2+ 2H2O.
(b) Fe + CuSO4 FeSO4 + Cu.
(c) (NH4)2CO3 + Ba(OH)2 BaCO3¯ + 2NH3 + 2H2O.
(d) 3NaOH + FeCl3 3NaCl + Fe(OH)3¯.
(e) 2NaOH + H2SO4 Na2SO4 + 2H2O.
Có 2 thí nghiệm thu được cả chất rắn và khí là: (a), (c).
Câu 31:
18/07/2024Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 20% về khối lượng) vào nước, thu được 300 ml dung dịch Y và 0,336 lít khí H2. Trộn 300 ml dung dịch Y với 200 ml dung dịch gồm HCl 0,2M và HNO3 0,3M, thu được 500 ml dung dịch có pH = 13. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Sơ đồ phản ứng: X + H2O Y + H2.
= 0,015 (mol).
Bào toàn nguyên tử H: 2= + 2(*).
nHCl = 0,04 (mol); = 0,06 (mol)
= 0,04 + 0,06 = 0,1 (mol).
H+ + OH- H2O (1)
0,1 0,1 (mol)
Sau phản ứng: pH = 13 pOH = 14 – 13 = 1 [OH]- = 0,1M
OH- dư sau phản ứng (1), (dư) = 0,1×0,5 = 0,05 (mol).
= 0,1 + 0,05 = 0,15 (mol).
Thay vào (*), ta có: 2= 0,15+ 2×0,015 = 0,09 (mol).
Bảo toàn nguyên tố O: nO(X) + =
nO(X) + 0,09 = 0,15 nO(X) = 0,06 (mol).
Ta có: %mO(X) = = 20%
mX = 4,8 (gam).
Câu 32:
18/07/2024Hòa tan hoàn toàn 6,44 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Sơ đồ phản ứng: X + H2SO4 Muối + H2.
= 0,06 (mol) = = 0,06 (mol).
mmuối = mX + = 6,44 + 0,06×96 = 12,2 (gam).
Câu 33:
22/07/2024Cho 100 ml dung dịch FeCl2 1M tác dụng với 200 ml dung dịch AgNO3 4M, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
= 0,1 (mol) = 0,1 (mol); = 0,2 (mol).
= 0,8 (mol) = = 0,8 (mol).
Phương trình hóa học:
Fe2+ + Ag+ Fe3+ + Ag¯ (tính theo )
0,1 0,1 0,1 (mol)
(dư) = 0,8 – 0,1 = 0,7 (mol).
Ag+ + Cl- AgCl¯ (tính theo )
0,2 0,2 0,2 (mol)
m¯ = mAg + mAgCl = 0,1×108 + 0,2×143,5 = 39,5 (gam).
Câu 34:
19/07/2024Tiến hành các thí nghiệm sau:
(a) Cho dung dịch NaOH vào dung dịch Ba(HCO3)2.
(b) Cho dung dịch NH3 đến dư vào dung dịch AlCl3.
(c) Sục khí CO2 vào dung dịch Ca(OH)2 dư.
(d) Cho dung dịch AgNO3 vào dung dịch MgCl2.
(e) Cho Mg vào dung dịch FeCl3 dư.
(f) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
(a) 2NaOH + Ba(HCO3)2 BaCO3¯ + Na2CO3 + 2H2O.
(b) 3NH3 + AlCl3 + 3H2O Al(OH)3¯ + 3NH4Cl.
¯Al(OH)3 không tan trong NH3 dư.
(c) CO2 + Ca(OH)2 CaCO3¯ + H2O.
(d) 2AgNO3 + MgCl2 2AgCl¯ + Mg(NO3)2.
(e) Mg + 2FeCl3 dư MgCl2 + 2FeCl2.
(f) AgNO3 + Fe(NO3)2 Fe(NO3)3 + Ag¯.
Có 5 thí nghiệm thu được kết tủa là: (a), (b), (c), (d), (f).
Câu 35:
18/07/2024Hoà tan a gam hỗn hợp bột Fe, Al bằng dung dịch HCl thu được 17,92 lit khí H2. Cùng lượng hỗn hợp trên hoà tan trong dung dịch NaOH dư thu được 13,44 lít khí H2. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Tác dụng với dung dịch HCl: = 0,8 (mol).
Bảo toàn e: 2nFe + 3nAl = 2 2nFe + 3nAl = 1,6 (1).
Tác dụng với dung dịch NaOH: = 0,6 (mol).
Bảo toàn e: 3nAl = 2 nAl = 0,4 (mol)
Thay vào (1), suy ra: nFe = 0,2 (mol).
a = mFe + mAl = 0,2×56 + 0,4×27 = 22 (gam).
Câu 36:
19/07/2024Cho m gam hỗn hợp X gồm Na và Al vào nước thu được dung dịch X; 5,376 lit H2 và 6,75 gam chất rắn không tan. Nếu oxi hoá m gam X cần V lít khí Cl2. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Cho hỗn hợp X (Na, Al) vào nước:
Na + H2O NaOH + H2
x x 0,5x (mol)
NaOH + Al + H2O NaAlO2 + H2
x x 1,5x (mol)
= 0,24 (mol); mAl (dư) = 6,75 (gam) nAl (dư) = 0,25 (mol).
Gọi nNa = x (mol).
= 0,5x + 1,5x = 0,24 x = 0,12.
Vậy trong X: nNa = 0,12 (mol); nAl = 0,12 + 0,25 = 0,37 (mol).
Oxi hoá m gam X bằng khí Cl2:
Bảo toàn e: nNa + 3nAl = 2 = 0,615 (mol).
V = = 0,615×22,4 = 13,776 (lít).
Câu 37:
23/07/2024Cho m gam hỗn hợp X gồm Al và Al2O3 tác dụng với dung dịch NaOH dư, thì có 0,5 mol NaOH đã phản ứng, sau phản ứng thu được 3,36 lít khí H2. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Phương trình hóa học:
Al + NaOH + H2O NaAlO2 + H2
0,1 0,1 0,15 (mol)
Al2O3 + 2NaOH 2NaAlO2 + H2O
0,2 0,4 (mol)
= 0,15 (mol).
m = mAl + = 0,1×27 + 0,2×102 = 23,1 (gam).
Câu 38:
19/07/2024Cho khí CO dư đi qua 24 gam hỗn hợp X gồm CuO, Fe2O3 và MgO nung nóng, thu được m gam chất rắn Y và hỗn hợp khí Z. Dẫn từ từ toàn bộ khí Z vào 0,2 lít dung dịch gồm Ba(OH)2 1M và NaOH 1M, thu được 29,55 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Sơ đồ phản ứng: X + CO(dư) Rắn Y + Z .
Bản chất phản ứng: CO + [O] CO2.
= 0,2 (mol); nNaOH = 0,2 (mol); (mol)
= 2×0,2 + 0,2 = 0,6 (mol); = 0,2 (mol) = n¯Max
Ta có đồ thị sau:
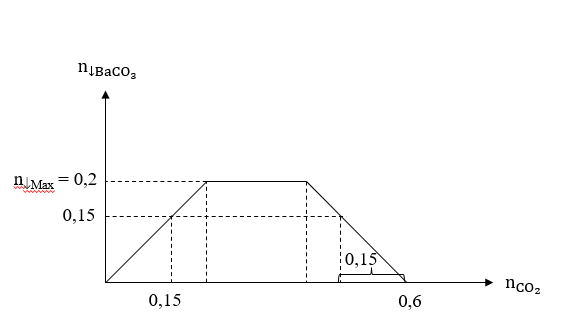
Trường hợp 1: = 0,15 (mol).
nO(X)pư = = 0,15 (mol).
mY = mX - mO(X)pư = 24 – 0,15×16 = 21,6 (gam) m » 22.
Trường hợp 2: = 0,6 – 0,15 = 0,45 (mol).
nO(X)pư = = 0,45 (mol).
mY = mX - mO(X)pư = 24 – 0,45×16 = 16,8 (gam) m » 17.
→ Giá trị của m gần nhất với 17.
Câu 39:
22/07/2024Cho 1,82 gam hỗn hợp bột X gồm Cu và Ag (tỉ lệ số mol tương ứng 4 : 1) vào 30 ml dung dịch gồm H2SO4 0,5M và HNO3 2M, sau khi các phản ứng xảy ra hoàn toàn, thu được a mol khí NO (sản phẩm khử duy nhất của N+5). Trộn a mol NO trên với 0,1 mol O2 thu được hỗn hợp khí Y. Cho toàn bộ Y tác dụng với H2O, thu được 150 ml dung dịch có pH = z. Giá trị của z là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Ta có hệ phương trình:
= 0,015 (mol); = 0,06 (mol).
= 0,015×2 + 0,06 = 0,09 (mol); = 0,06 (mol).
Để hòa tan được hết hỗn hợp kim loại thì:
Bảo toàn e: 3nNO = 2nCu + nAg nNO = 0,015 (mol).
= nNO = 0,015 (mol) < 0,06 (mol);
= 4nNO = 0,06 (mol) < 0,09 (mol).
Hỗn hợp Cu và Ag tan hết nNO = 0,015 (mol).
2NO + O2 2NO2
0,015 0,0075 0,015 (mol)
Hỗn hợp Y gồm: NO2 (0,015 mol); O2 dư (0,1 – 0,0075 = 0,0925 mol).
Cho toàn bộ Y tác dụng với H2O:
4NO2 + O2 + 2H2O 4HNO3 (tính theo )
0,015 0,015 (mol)
[H+] = = 0,1M pH = -lg[H+] = 1.
Câu 40:
18/07/2024Điện phân dung dịch X gồm CuSO4 và KCl (tỉ lệ mol tương ứng là 1: 5) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 2A. Sau 1930 giây, thu được dung dịch Y và hỗn hợp khí gồm H2 và Cl2 (có tỉ khối so với H2 là 24). Mặt khác, nếu điện phân X trong thời gian t giây thì khối lượng dung dịch giảm 2,715 gam. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của t là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
|
Catot (-): Cu2+, K+, H2O |
Anot (+): , Cl-, H2O |
|
Cu2+ + 2e Cu x 2x x (mol) 2H2O + 2e H2 + 2OH- (0,04-2x) (mol) |
2Cl- Cl2 + 2e 0,04 0,02 0,04 (mol) 2H2O O2 + 4H+ + 4e |
Số mol e trao đổi trong thời gian 1930 giây là:
ne(TĐ) = = 0,04 (mol).
Gọi = x (mol) nKCl = 5x (mol).
ne(TĐ) = 2x + 2= 0,04 = (0,02 – x) (mol).
Hỗn hợp khí gồm H2 và Cl2 có tỉ khối so với H2 là 24.
Áp dụng quy tắc đường chéo:
x = 0,01.
= 0,01 (mol); nKCl = 0,05 (mol).
Khi điện phân t giây:
|
Catot (-): Cu2+, K+, H2O |
Anot (+):, Cl-, H2O |
|
Cu2+ + 2e Cu 0,01 0,02 0,01 (mol) 2H2O + 2e H2 + 2OH- 2a 2a a |
2Cl- Cl2 + 2e 0,05 0,025 0,05 (mol) 2H2O O2 + 4H+ + 4e 2 b 4b |
Nếu điện phân hoàn toàn:
mCu + = 0,01×64 + 0,025×71 = 2,415 (gam) < 2,715 (gam).
Có H2O tham gia điện phân.
Gọi số mol H2 và O2 sinh ra ở các điện cực lần lượt là a, b (mol).
Bảo toàn e: ne TĐ(-) = ne TĐ(+) 0,02 + 2a = 0,05 + 4b (*).
mdd giảm = mCu + + +
0,01×64 + 0,025×71 + 2a + 32b = 2,715 (**)
Từ (*) và (**), suy ra: a = 0,03; b = 0,0075.
neTĐ = 0,02 + 2a = t = 3860 (giây).
Bài thi liên quan
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 1)
-
40 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 2)
-
40 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 3)
-
40 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 5)
-
32 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 6)
-
30 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 7)
-
40 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 8)
-
32 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 9)
-
29 câu hỏi
-
90 phút
-
Có thể bạn quan tâm
- Đề thi Hóa Học 12 giữa kì 2 có đáp án (2928 lượt thi)
- 30 Câu trắc nghiệm bài thi giữa kì 2 có đáp án (324 lượt thi)
- 40 câu trắc nghiệm bài thi học kì 2 có đáp án (310 lượt thi)
- Top 12 Đề kiểm tra 15 phút Hóa 12 Học kì 2 có đáp án (Bài số 1) (2325 lượt thi)
- Top 9 Đề thi giữa kì 2 Hóa 12 có đáp án (Bài số 1) (1737 lượt thi)
- Top 8 Đề kiểm tra 15 phút Hóa 12 Học kì 2 có đáp án (Bài số 2) (1320 lượt thi)
- Top 9 Đề thi giữa kì 2 Hóa 12 có đáp án (Bài số 2) (3744 lượt thi)
- Top 9 Đề thi Hóa học 12 Học kì 2 có đáp án (1920 lượt thi)
- Đề thi cuối kì 2 Hóa 12 có đáp án (3379 lượt thi)
Các bài thi hot trong chương
- Top 4 Đề kiểm tra 15 phút Hóa 12 Học kì 1 có đáp án (Lần 1) (1172 lượt thi)
- Top 4 Đề thi Hóa học 12 Học kì 1 có đáp án (1028 lượt thi)
- Top 4 Đề thi giữa kì 1 Hóa 12 có đáp án (Lần 2) (840 lượt thi)
- Top 4 Đề thi giữa kì 1 Hóa 12 có đáp án (Lần 1) (835 lượt thi)
- Top 4 Đề thi Hóa học 12 Học kì 1 chọn lọc, có đáp án (776 lượt thi)
- Đề kiểm tra 1 tiết Hóa học 12 có đáp án (Bài kiểm tra số 1) (391 lượt thi)
- Đề kiểm tra 1 tiết Hóa học 12 có đáp án (Bài kiểm tra số 2) (341 lượt thi)
- 40 Câu trắc nghiệm bài thi giữa kì 2 có đáp án (314 lượt thi)
