Đề thi Hóa Học 12 giữa kì 2 có đáp án
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 1)
-
2819 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 2:
22/07/2024Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Thứ tự các ion trong dãy điện hóa:
Ca2+; Zn2+; Cu2+; Ag+
→ Ion Ag+ có tính oxi hoá mạnh nhất
Câu 3:
16/07/2024Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CO2 + H2O + CaCO3 → Ca(HCO3)2
Câu 4:
22/07/2024Thuỷ ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thuỷ ngân bị vỡ thì dùng chất nào trong các chất sau để khử độc thuỷ ngân:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Lưu huỳnh tác dụng với thuỷ ngân ở nhiệt độ thường tạo chất rắn HgS không độc.
Câu 5:
16/07/2024Al có thể tan được trong dung dịch nào sau:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2
Câu 6:
21/07/2024Trong tự nhiên, chất X tồn tại dưới dạng ngậm nước X.2H2O gọi là thạch cao sống. Công thức của X là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Công thức của thạch cao sống là CaSO4.2H2O
Câu 7:
23/07/2024Phát biểu nào sau đây sai:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
B sai vì Cu không tác dụng với dung dịch H2SO4 loãng
Câu 8:
20/07/2024Để bảo quản natri, người ta phải ngâm natri trong:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Để bảo quản natri, người ta phải ngâm mẫu natri trong dầu hoả.
Câu 9:
21/07/2024Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
2Na + 2H2O → 2NaOH + H2
Câu 10:
21/07/2024Cho 6,0 gam bột Mg tác dụng hoàn toàn với dung dịch CuSO4 dư, thu được m gam kim loại Cu. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Bảo toàn e: 2nMg = 2ncu nMg = nCu = 0,25mol
→ m = 0,25.64 = 16 gam.
Câu 11:
20/07/2024Nước cứng là nước có chứa nhiều các ion:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Nước cứng là nước có chứa nhiều các ion Ca2+ và Mg2+.
Câu 12:
22/07/2024Dung dịch làm quỳ tím chuyển sang màu xanh là:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
NaOH có tính bazơ nên làm đổi màu quỳ tím sang màu xanh.
Câu 13:
23/07/2024Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3 tác dụng với dung dịch:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Câu 14:
20/07/2024Để thu được kim loại Cu từ dung dịch CuSO4 theo phương pháp thuỷ luyện, có thể dùng kim loại nào sau đây:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Fe + CuSO4 → FeSO4 + Cu
Câu 15:
23/07/2024Cho hỗn hợp X gồm Cu, Ag. Để thu được Ag tinh khiết người ta cho X tác dụng với
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Cho hỗn hợp X tác dụng với dung dịch AgNO3 dư thì Cu phản ứng thu được kim loại Ag. Lọc lấy kim loại rửa sạch thu được Ag tinh khiết.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Ag + AgNO3 → không phản ứng
Câu 16:
16/07/2024Cho 5,85 gam K tác dụng với dung dịch HCl dư, phản ứng xảy ra hoàn toàn, thu V lít khí H2 (đktc). Giá trị của V là:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Bảo toàn e:
→ V = 0,075.22,4 =1,68 lít
Câu 17:
22/07/2024Kim loại nào sau đây là kim loại kiềm?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Kim loại kiềm gồm các nguyên tố: Li, Na, K, Rb, Cs.
→ Li là kim loại kiềm.
Câu 18:
20/07/2024Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
Câu 19:
16/07/2024Kim loại ở thể lỏng ở điều kiện thường là:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Hg là kim loại ở thể lỏng ở điều kiện thường.
Câu 20:
23/07/2024Cho 16,25 gam Zn tác dụng vừa đủ với V lít dung dịch HCl 1M thu khí H2. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Zn + 2HCl → ZnCl2 + H2
Theo phương trình:
→ V = 0,5 lít
Câu 21:
19/07/2024Dãy gồm các kim loại được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng là:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Dãy gồm các kim loại Na, Ca, Al được điều chế trong công nghiệp bằng phương pháp điện phân hợp chất nóng chảy của chúng.
Câu 22:
21/07/2024Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là ns2.
Câu 23:
23/07/2024Đốt cháy m gam Cu trong Clo dư. Sau khi phản ứng hoàn toàn thu được 27 gam muối đồng clorua CuCl2. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Bảo toàn nguyên tố Cu:
→ m = 0,2.64 = 12,8g
Câu 24:
21/07/2024Trường hợp nào sau đây, kim loại bị ăn mòn điện hóa học?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Trường hợp thép cacbon để trong không khí ẩm thì sắt bị ăn mòn điện hoá học
Câu 25:
16/07/2024Kim loại có tính dẻo cao nhất là:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Au là kim loại có tính dẻo cao nhất.
Câu 26:
18/07/2024Hòa tan m gam Al vào dung dịch NaOH dư. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 lít khí H2 đktc. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Bảo toàn e:
→ m = 2,7 gam
Câu 27:
21/07/2024Chất nào sau đây không có tính chất lưỡng tính:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
AlCl3 không có tính chất lưỡng tính
Câu 28:
23/07/2024Quặng boxit được dùng để sản xuất kim loại nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Quặng boxit dùng để sản xuất kim loại Al.
Câu 29:
23/07/2024Đề bảo vệ ống thép (dẫn nước, dẫn dầu, dẫn khi đốt) bằng phương pháp điện hóa, người ta mạ vào mặt ngoài của ống thép bằng kim loại gì?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Để bảo vệ ống thép bằng phương pháp điện hoá, người ta mạ vào mặt ngoài của ống thép kim loại kẽm.
Câu 30:
21/07/2024Thực hiện các thí nghiệm sau:
(a) Đun nóng dung dịch Ca(HCO3)2.
(b) Nhiệt phân Na2CO3 ở nhiệt độ cao.
(c) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(d) Cho từ từ dung dịch chứa 1,la mol KHSO4 vào dung dịch chứa a mol NaHCO3.
(e) Cho dung dịch NaOH vào dung dịch NH4Cl rồi đun nóng.
Sau khi các phản ứng kết thúc, số thí nghiệm tạo thành chất khí là:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Những thí nghiệm tạo thành chất khí là: (a), (c), (d), (e).
Câu 31:
23/07/2024Hỗn hợp X gồm: Na, Ca, Na2O và CaO. Hòa tan hết 29,1 gam hỗn hợp X vào nước thu 4,48 lít khí H2 (đktc) và dung dịch kiềm Y trong đó có 22,2 gam Ca(OH)2. Hấp thụ hết 16,8 lít khí CO2 vào dung dịch Y thu được m gam kết tủa. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Quy đổi hỗn hợp X thành Na (x mol), Ca (0,3 mol) và O (y mol)
Vì nCa < 0,35 mol
Câu 32:
22/07/2024Có các kim loại Na, K, Cu, Al, Fe, Mg, Ba. Số kim loại tan được trong dung dịch NaOH là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Những kim loại tan được trong dung dịch NaOH: Na, K, Al, Ba.
Chú ý: Na, K, Ba tác dụng với nước có trong dung dịch.
Câu 33:
19/07/2024Cho các phát biểu sau:
(1) Cho khí H2 dư qua hỗn hợp bột Fe2O3 và CuO nung nóng, thu được Fe và Cu.
(2) Cho kim loại Ba tác dụng với dung dịch CuSO4, thu được kim loại Cu.
(3) Cho AgNO3 tác dụng với dung dịch FeCl3, thu được kim loại Ag.
(4) Cho một lá sắt vào dung dịch HCl thì xảy ra ăn mòn hóa học.
(5) Be không khử được nước ngay cả khi đun nóng.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
- Những phát biểu đúng là: (1), (4), (5)
- Phát biểu (2) sai vì:
Ba + 2H2O → Ba(OH)2 + H2↑
CuSO4 + Ba(OH)2 → Cu(OH)2↓ + BaSO4↓
- Phát biểu (3) sai vì: 3AgNO3 + FeCl3 → 3AgCl↓ + Fe(NO3)3.
Câu 34:
23/07/2024Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (ở đktc) và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Bảo toàn electron:
Câu 35:
22/07/2024Cho m gam hỗn hợp X gồm Al, Zn, Mg tác dụng với oxi, thu được 19,35 gam chất rắn Y. Để hòa tan vừa hết Y cần dùng V ml dung dịch chứa HCl 1M, sau phản ứng thu được 0,56 lít khí H2 (dktc) và 43,125 gam muối trong dung dịch. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Gọi số mol HCl là x mol
Bảo toàn nguyên tố H:
Câu 36:
23/07/2024Thực hiện các phản ứng sau:
(1) X + Y Z + H2O
(2) Y Z + H2O + E
(3) E + X Y
(4) E + X Z + H2O
Biết X, Y, Z là các hợp chất vô cơ của một kim loại, khi đốt nóng ở nhiệt độ cao cho ngọn lửa màu vàng. Các chất X, Y, Z, E lần lượt là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
X là NaOH, Y là NaHCO3, Z là Na2CO3, E là CO2
NaOH + NaHCO3 → Na2CO3 + H2O
2NaHCO3 Na2CO3 + CO2 + H2O
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
Câu 37:
23/07/2024Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng, thu được hỗn hợp rắn Y. Chia Y thành 2 phần bằng nhau:
- Phần 1 cho tác dụng hết với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan.
- Phần 2 cho tác dụng hết với dung dịch HNO3 dư thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất.
Khối lượng của Fe3O4 có trong m gam X là:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
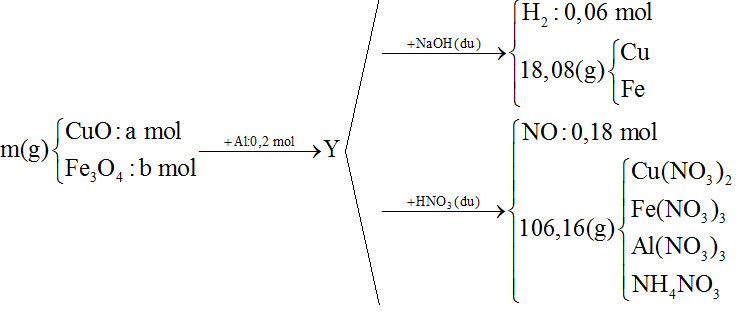
Coi trong mỗi phần có 0,2 mol Al
Xét quá trình phản ứng với NaOH dư
BTE:
Bảo toàn Al:
→ nO = 0,08.3 = 0,24 mol
Bảo toàn khối lượng:
m = mFe + mCu + mO = 18,08 + 0,24.16 = 21,92 gam
Đặt số mol CuO và Fe3O4 trong hỗn hợp X là a mol và b mol
→ 80a + 232b = 21,92 (1)
Xét quá trình phản ứng với HNO3 dư
BTE:
Mà
→ 213.0,2 + 188a + 242.3b + 80(2)
Từ (1) và (2)
Câu 38:
22/07/2024Nung hỗn hợp X gồm a gam Mg và 64,86 gam Cu(NO3)2, sau một thời gian, thu được chất rắn Y và 6,272 lít (đktc) hỗn hợp khí X gồm NO2 và O2. Cho Y phản ứng vừa đủ với dung dịch chứa 3,47 mol HCl, thu được dung dịch G chỉ chứa m gam hỗn hợp muối clorua và 5,04 lít (đktc) hỗn hợp khí T gồm N2 và H2 có tỉ khối so với H2 là 11,4. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
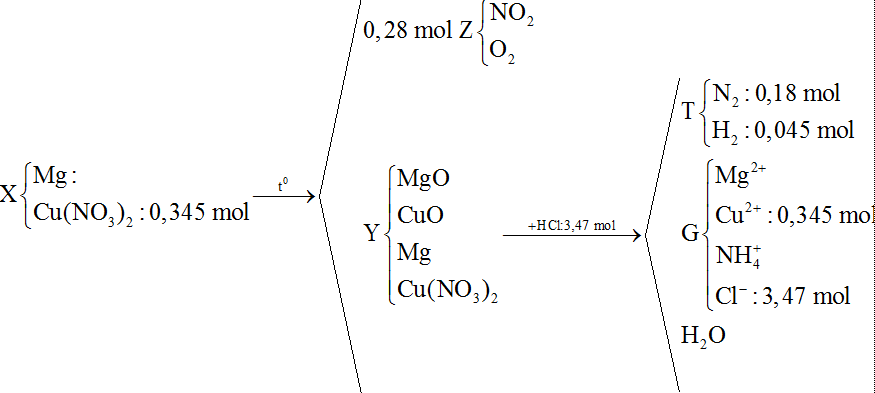
Bảo toàn nguyên tố O:
→ nO(Y) = 0,151 mol
Bảo toàn nguyên tố H:
Bảo toàn điện tích cho dung dịch G:
Câu 39:
22/07/2024Rót từ từ dung dịch HCl vào dung dịch hỗn hợp X chứa a mol K2CO3 và 1,25a mol KHCO3 ta có đồ thị như sau:
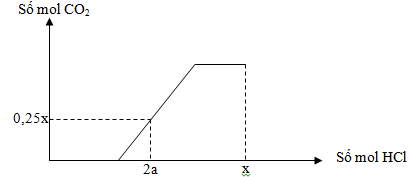
Khi số mol HCl là x thì dung dịch chứa 97,02 gam chất tan. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Ta có:
→ 2a = a + 0,25x → x = 4a
Khi nHCl = 4a thì dung dịch chứa K+ (3,25a mol), Cl- (4a mol)
Bảo toàn điện tích:
→ mchất tan = 3,25a.39 + 35,5.4a + 0,75a = 97,02
→ a = 0,36
Câu 40:
23/07/2024Hòa tan hết m gam hỗn hợp E gồm Al, Mg, MgO trong dung dịch hỗn hợp gồm HNO3 (0,34 mol) và KHSO4. Sau phản ứng thu được 8,064 lít (đktc) hỗn hợp khí X gồm NO, H2 và NO2 với tỉ lệ mol tương ứng 10 : 5 : 3 và dung dịch Y chỉ chứa muối. Cho NaOH dư vào Y thì có 2,28 mol NaOH tham gia phản ứng, đồng thời thu được 17,4 gam kết tủa xuất hiện. Phần trăm khối lượng của Mg trong E là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Hỗn hợp X gồm NO (0,2 mol), H2 (0,1 mol) và NO2 (0,06 mol)
Bảo toàn nguyên tố N:
→ Y gồm Al3+ (x mol), Mg2+ (0,3 mol), NH4+ (0,08 mol), K+, SO42-
Bảo toàn e:
→ nMg = 0,15 mol
Bảo toàn nguyên tố Mg: → nMgO = 0,3 – 0,15 = 0,15 mol
→ %mMg = 17,65%
Bài thi liên quan
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 2)
-
40 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 3)
-
40 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 4)
-
40 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 5)
-
32 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 6)
-
30 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 7)
-
40 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 8)
-
32 câu hỏi
-
90 phút
-
-
Đề thi Hóa Học 12 giữa kì 2 có đáp án (đề 9)
-
29 câu hỏi
-
90 phút
-
Có thể bạn quan tâm
- Đề thi Hóa Học 12 giữa kì 2 có đáp án (2818 lượt thi)
- 30 Câu trắc nghiệm bài thi giữa kì 2 có đáp án (306 lượt thi)
- 40 câu trắc nghiệm bài thi học kì 2 có đáp án (300 lượt thi)
- Top 12 Đề kiểm tra 15 phút Hóa 12 Học kì 2 có đáp án (Bài số 1) (2197 lượt thi)
- Top 9 Đề thi giữa kì 2 Hóa 12 có đáp án (Bài số 1) (1644 lượt thi)
- Top 8 Đề kiểm tra 15 phút Hóa 12 Học kì 2 có đáp án (Bài số 2) (1237 lượt thi)
- Top 9 Đề thi giữa kì 2 Hóa 12 có đáp án (Bài số 2) (3618 lượt thi)
- Top 9 Đề thi Hóa học 12 Học kì 2 có đáp án (1817 lượt thi)
- Đề thi cuối kì 2 Hóa 12 có đáp án (3184 lượt thi)
Các bài thi hot trong chương
- Top 4 Đề kiểm tra 15 phút Hóa 12 Học kì 1 có đáp án (Lần 1) (1134 lượt thi)
- Top 4 Đề thi Hóa học 12 Học kì 1 có đáp án (961 lượt thi)
- Top 4 Đề thi giữa kì 1 Hóa 12 có đáp án (Lần 1) (808 lượt thi)
- Top 4 Đề thi giữa kì 1 Hóa 12 có đáp án (Lần 2) (806 lượt thi)
- Top 4 Đề thi Hóa học 12 Học kì 1 chọn lọc, có đáp án (739 lượt thi)
- Đề kiểm tra 1 tiết Hóa học 12 có đáp án (Bài kiểm tra số 1) (367 lượt thi)
- Đề kiểm tra 1 tiết Hóa học 12 có đáp án (Bài kiểm tra số 2) (327 lượt thi)
- 40 Câu trắc nghiệm bài thi giữa kì 2 có đáp án (303 lượt thi)
