Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (24 đề)
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 13)
-
5366 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 2:
23/07/2024Al2O3 không tan được trong dung dịch chứa chất tan nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Al2O3 là hợp chất lưỡng tính nên tác dụng được với dung dịch axit và dung dịch bazơ.
Câu 3:
19/07/2024Chất nào sau đây thuộc polisaccarit?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Cacbohiđrat được chia thành:
Monosaccarit: Glucozơ và fructozơ.
Đisaccarit: Saccarozơ.
Polisaccarit: Tinh bột và xenlulozơ.
Câu 4:
19/07/2024Kim loại nào dưới đây không phản ứng được với H2O ở nhiệt độ thường?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích
Các chất tác dụng được với nước ở nhiệt độ thường gồm các kim loại kiềm, kim loại kiềm thổ (trừ Be).
Chú ý: Mg phản ứng chậm với nước ở nhiệt độ thường.
Câu 5:
20/07/2024Ion kim loại nào sau đây có tính oxi hóa yếu nhất?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Trong dãy điện hóa của kim loại, từ trái sang phải, tính oxi hóa của các ion kim loại tăng dần.
→ Tính oxi hóa:
Câu 6:
19/07/2024Poli(vinyl doma) (PVC) được điều chế từ phản ứng trùng hợp chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Poli(vinyl doma) được điều chế từ monome tương ứng là vinyl clorua có công thức: CH2 = CHCl.
Câu 7:
19/07/2024Sắt bị thụ động trong dung dịch axit nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp ấn
Giải thích:
Các kim loại bị thụ động trong dung dịch HNO3 đặc, nguội và H2SO4 đặc, nguội là Al, Fe, Cr.
Câu 8:
21/07/2024Chất hữu cơ X tác dụng được với dung dịch HCl và khi X tác dụng với dung dịch brom tạo kết tủa. Tên gọi của X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Chất hữu cơ X tác dụng được với dung dịch HCl nên X có thể là anilin, alanin, etylamin.
Tuy nhiên khi X tác dụng với dưng dịch brom tạo kết tủa nên X là anilin.
Câu 9:
23/07/2024Một chiếc nhiệt kế bị vỡ, để thu hồi thủy ngân rơi vãi tránh độc, người ta có thể dùng
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Người ta dùng bột lưu huỳnh để thu hồi thủy ngân rơi vãi do lưu huỳnh tác dụng được với thủy ngân ngay ở nhiệt độ thường:
Câu 10:
20/07/2024Hòa tan hết m gam bột nhôm trong dung dịch HCl dư, thu được 0,16 mol H2. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Nhớ nhanh
Câu 11:
19/07/2024Cặp ion nào sau đây cùng tồn tại trong một dung dịch?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Điều kiện để các ion có thể cùng tồn tại trong một dung dịch là khi các ion đó kết hợp với nhau không tạo ra kết tủa hoặc bay hơi hoặc chất điện li yếu.
A đúng
Câu 12:
19/07/2024Ankan có 81,819% C về khối lượng. Công thức phân tử của ankan là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Câu 13:
19/07/2024Chất nào sau đây không tạo kết tủa khi tác dụng với dung dịch Na3PO4?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Chỉ có muối photphat của kim loại kiềm và amoni là tan được còn lại thì muối của các kim loại khác đều không tan nên CaCl2, Mg(HCO3)2, AgNO3 đều tạo kết tủa với Na3PO4.
Chỉ có HCl là không tạo kết tủa với Na3PO4.
Câu 14:
19/07/2024Trong phòng thí nghiệm, để xử lí sơ bộ một số chất thải ở dạng dung dịch chứa ion Fe2+ và Cu2+ ta dùng lượng dư
 Xem đáp án
Xem đáp án
Chọn đáp án A
Gải thích:
Người ta dùng lượng dư nước vôi trong do dễ kiếm, hiệu quả và rẻ tiền:
Fe2+ + 2OH– → Fe(OH)2↓
Cu2+ + 2OH– → Cu(OH)2↓
Câu 15:
19/07/2024Thủy phân este nào sau đây trong dung dịch NaOH vừa đủ thu được natri axetat và ancol?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Thủy phân este thu được natri axetat nên dựa vào đáp án este đó có dạng CH3COOR’
→ Loại B, C.
Lại có sau phản ứng thu đươc ancol → Loại A vì có phương trình hóa học:
CH3COOCH = CH2 + NaOH → CH3COONa + CH3CHO
(anđehit axetic)
D đúng vì có phương trình hóa học:
CH3COOCH3 + NaOH → CH3COONa + CH3OH
(ancol metylic)
Câu 16:
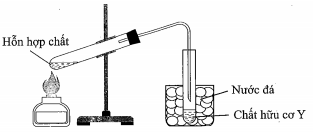
19/07/2024Cho sơ đồ điều chế chất hữu cơ Y như hình vẽ bên. Phản ứng nào sau đây có thể phù hợp với sơ đồ điều chế chất Y?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Chất Y được điều chế từ hỗn hợp chất lỏng → Loại B, D (do Cu(OH)2, CaC2 là chất rắn). Khi thu Y cần sử dụng nước đá Y là chất dễ bay hơi → Loại C
Câu 17:
21/07/2024Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 0,1 mol dung dịch Ba(OH)2 thì thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Câu 18:
19/07/2024Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
D sai vì saccarozơ được tạo bởi hai monosaccarit là glucozơ và fructozơ.
Câu 19:
22/07/2024X là một -amino axit chứa một nhóm NH2. Cho m gam X phản ứng vừa đủ với 25 ml dung dich HCl 1M, thu được 3,1375 gam muối. X là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Câu 20:
20/07/2024Este X mạch hở có công thức phân tử là C5H10O2. Thủy phân hoàn toàn X trong dung dịch NaOH dư, đun nóng, thu được 5,76 gam muối cacboxylat và 2,76 gam ancol. Tên gọi của X là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Dựa vào công thức phân tử → X là este no, đơn chức mạch hở, có công thức dạng RCOOR’ (a mol).
Câu 21:
19/07/2024Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
A đúng vì crom có lớp màng oxit Cr2O3 bền bảo vệ nên có thể bảo vệ kim loại khỏi bị ăn mòn.
B đúng vì đây là tính chất vật lí của crom.
C đúng vì crom được dùng để sản xuất thép không gỉ (inox).
D sai vì muối Cr(III) có số oxi hóa là +3 là số oxi hóa trung gian nên vừa thể hiện tính oxi hóa, vừa thể hiện tính khử.
Câu 22:
19/07/2024Đốt cháy hoàn toàn m gam triglixerit X cần 1,61 mol O2, sinh ra 1,14 mol CO2 và 1,06 mol H2O. Cho 7,088 gam X tác dụng vừa đủ với dung dịch NaOH thì khối lượng muối tạo thành là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Đốt cháy hoàn toàn m gam triglixerit X:
Câu 23:
19/07/2024Cho dãy các dung dịch sau: metylamin, anilin, lysin, alanin. Số dung dịch trong dãy làm quỳ tím chuyển sang màu xanh là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Dung dịch các chất làm quỳ tím hóa xanh là metylamin, lysin.
Chú ý: Anilin có tính bazo rất yếu, không làm quỳ tím đổi màu.
Alanin có số nhóm NH2 = số nhóm COOH nên không làm quỳ tím đổi màu.
Câu 24:
20/07/2024Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn dáp án C
Giải thích:
A đúng vì là khái niệm của protein.
B đúng vì protein được tạo bởi nhiều gốc -amino axit nên trong phân tử luôn có nguyên tố nitơ.
C sai vì không phải tất cả mà chỉ là nhiều các protein tan trong nước và tạo thành dung dịch keo.
D đúng vì protein chứa nhiều liên kết peptit nên có phản ứng màu biure.
Câu 25:
19/07/2024Cho dãy các chất: FeCl2, CuSO4, BaCl2 và KNO3. Số chất trong dãy phản ứng được với dung dịch NaOH là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích;
Các chất phản ứng được với dung dịch NaOH là FeCl2, CuSO4.
Các chất BaCl2 và KNO3 không phản ứng được với dung dịch NaOH là do không thỏa mãn điều kiện để phản ứng trao đổi xảy ra.
Câu 26:
19/07/2024Hỗn hợp X gồm glyxin, alanin và axit glutamic (trong đó nguyên tố oxi chiếm 41,2% về khối lượng). Cho m gam X tác dụng với dung dịch NaOH dư, thu được 20,532 gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Câu 27:
19/07/2024Cho 2,603 gam Ba vào 100 ml dung dịch chứa Al2(SO4)3 0,05M đến khi phản ứng hoàn toàn, thu được m gam kết tủa. Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thich:
Câu 28:
19/07/2024Kết quả thí nghiệm của các hợp chất hữu cơ X, Y, Z, T như sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Dung dịch AgNO3/NH3 đun nóng |
Kết tủa Ag trắng sáng |
|
Y |
Cu(OH)2 ở nhiệt độ thường |
Dung dịch xanh lam |
|
z |
Nước brom |
Nhạt màu nước brom |
|
T |
Quỳ tím |
Hoá xanh |
Các chất X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Dựa vào đáp án ta phân tích:
Chat X khi cho tác dụng với dung dịch AgNO3 trong NH3 đun nóng thu được kết tủa Ag → X là metyl fomat hoặc axit metanoic → Loại A.
Chất Z làm nhạt màu nước brom → Z là glucozơ → Loại C và D.
Vậy X, Y, Z, T lần lượt là: Metyl fomat, axit metanoic, glucozơ, metylamin
Câu 29:
19/07/2024Đốt cháy hoàn toàn 5,4 gam hỗn hợp X gồm axit acrylic, axit oleic, vinyl axetat, metyl acrylat cần vừa đủ V lít O2 (ở đktc). Hấp thụ toàn bộ sản phẩm cháy vào nước vôi trong dư, sau khi phản ứng hoàn toàn thu được 30 gam kết tủa. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Câu 30:
19/07/2024Cho hỗn hợp Na2C03 và KHC03 (tỉ lệ số mol tương ứng là 2 :1) vào bình chứa dung dịch Ba(HCG3)2 thu được m gam kết tủa X và dung dịch Y. Thêm tiếp dung dịch HCl IM vào bình đến khi không còn khí thoát ra thì hết 320 ml. Biết Y phản ứng vừa đủ với 160 ml dung dịch NaOH IM. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Gọi số mol của Na2CO3, KHCO3, Ba(HCO3)2 lần lượt là 2a, a, b mol.
Thêm tiếp dung dịch HCl 1M vào bình. Coi bình vẫn gồm các muối ban đầu phản ứng với HCl vì cả kết tủa X và dung dịch Y đều tác dụng với HCl.
Câu 31:
19/07/2024Thực hiện các thí nghiệm sau:
(a) Nung nóng KNO3.
(b) Cho Fe(OH)2 vào dung dịch H2SO4 đặc, nóng, dư.
(c) Sục khí Cl2 vào dung dịch FeCl2.
(d) Cho dung dịch KHSO4 vào dung dịch FeCl2.
(e) Cho Si vào dung dịch NaOH.
Sau khi các phản ứng xảy ra, số thí nghiệm xảy ra phản ứng oxi hóa - khử là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Các thí nghiệm xảy ra phản ứng oxi hóa - khử là: (a), (b), (c), (e).
Câu 32:
20/07/2024Trong một bình kín chứa 0,35 mol C2H2; 1,65 mol H2 và một ít bột Ni. Nung nóng bình một thời gian, thu được hỗn hợp khí X có tỉ khối so với H2 bằng 8. Sục X vào lượng dư dung dịch AgNO3 trong NH3 đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y, 24 gam kết tủa và dung dịch Z. Hỗn hợp khí Y tác dụng vừa đủ với a mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Câu 33:
19/07/2024Hỗn hợp X gồm axit panmitic, axit stearic và triglixerit Y. Đốt cháy hoàn toàn m gam X, thu được 1,56 mol CO2 và 1,52 mol H2O. Mặt khác, m gam X tác dụng vừa đủ với 0,09 mol NaOH trong dung dịch, thu được glixerol và dung dịch chỉ chứa a gam hỗn hợp muối natri panmitat, natri stearat. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Khi cho X tác dụng với NaOH thu được dung dịch chỉ chứa muối natri panmitat, natri stearat nên triglixerit Y được tạo nên từ axit panmitic, axit stearic.
→ Y là trieste no, mạch hở.
Mà khi đốt cháy axit pânmitic, axit stearic (axit no, đơn chức, mạch hở) thu được
→ Khi đốt cháy hỗn hợp X gồm axit panmitic, axit stearic và triglixerit Y ta có:
Câu 34:
19/07/2024Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vào ống nghiệm: 1 ml dung dịch lòng trắng trứng và 1 ml dung dịch NaOH 30%.
Bước 2: Cho tiếp vào ống nghiệm 1 giọt dung dịch CuSO4 2%. Lắc nhẹ ống nghiệm, sau đó để yên khoảng 2-3 phút.
Số phát biểu đúng trong các phát biểu dưới đây là
(a) Sau bước 1, hỗn hợp thu được có màu hồng.
(b) Sau bước 2, hỗn hợp xuất hiện chất màu tím.
(c) Thí nghiệm trên chứng minh anbumin có phản ứng màu biure.
(d) Thí nghiệm trên chứng minh anbumin có phản ứng thủy phân trong môi trường kiềm.
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
(a) sai vì cho vào ống nghiệm dung dịch lòng trắng trứng và dung dịch NaOH, thu được hỗn hợp không màu.
(b) đúng, (c) đúng vì khi cho tiếp vào ống nghiệm dung dịch CuSO4 và lắc nhẹ, xảy ra phản ứng màu biure với Cu(OH)2 (sinh ra từ phản ứng của CuSO4 với NaOH) nên hỗn hợp chất xuất hiện chất màu tím.
(d) sai.
Câu 35:
19/07/2024Hỗn hợp E chứa ba este đều mạch hở, trong phân tử chỉ chứa một loại nhóm chức gồm este X , este Y và este Z . Đun nóng 0,4 mol E với dung dịch NaOH vừa đủ, thu được 25,7 gam hỗn hợp gồm ba ancol cùng dãy đồng đẳng và 49,1 gam hỗn hợp T gồm ba muối. Đốt cháy toàn bộ T cần dùng 0,275 mol O2, thu được Na2CO3 và 0,49 mol hỗn hợp gồm CO2 và H2O. Phần trăm khối lượng của Y trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Xem muối gồm: X mol HCOONa; y mol C2H3COONa; z mol (COONa)2 và a mol CH2. Ta có hệ bốn ẩn:
Câu 36:
19/07/2024Hòa tan hoàn toàn 16,86 gam hỗn hợp X gồm Al, Al2O3, Mg và MgCO3 trong dung dịch chứa đồng thời 1,14 mol NaHSO4 và 0,32 mol HNO3 thu được dung dịch Y chứa 156,84 gam muối trung hòa và 2,688 lít hỗn hợp khí Z gồm hai khí thoát ra (ở đktc), biết Z có tỉ khối hơi so với hiđro bằng 22. Cho dung dịch NaOH dư vào dung dịch Y thì thu được 19,72 gam kết tủa. Khối lượng của Al2O3 trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Trong Z chắc chắn có CO2
Câu 37:
22/07/2024Cho một lượng tinh thể Cu(NO3)2.5H2O vào dung dịch chứa 0,16 mol NaCl thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ, màng ngăn xốp, trong thời gian t giây ở anot thoát ra 3,584 lít khí (đktc) và thu được dung dịch Y. Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thoát ra ở hai cực là 8,960 lít (đktc). Cho m gam bột Fe vào Y, kết thúc phản ứng thấy khí NO thoát ra (sản phẩm khử duy nhất) và còn lại 0,6m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Câu 38:
19/07/2024Cho 4,6 gam hỗn hợp X gồm Mg và Fe vào dung dịch gồm AgNO3 và Cu(NO3)2, thu được chất rắn Y (gồm b kim loại) và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc, nóng, dư, thu được 3,192 lít khí SO2 (sản phẩm khử duy nhất của S+6, ở đktc). Cho dung dịch NaOH dư vào Z, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi, thu được 4,2 gam hỗn hợp rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm so mol của Fe trong X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Theo thứ tự xuất hiện kim loại thì chất rắn Y gồm ba kim loại là Ag, Cu, Fe.
Ta có quá trình:
Gọi số mol Mg, Fe phản ứng, Fe dư lần lượt là a, b, c mol.
Câu 39:
19/07/2024X là este no, hai chức, mạch hở; Y là este ba chức, mạch hở (được tạo bởi glixerol và một axit cacboxylic đơn chức, có chứa hai liên kết TC). Đốt cháy hoàn toàn 17,02 gam hỗn hợp E chứa X, Y thu được 18,144 lít CO2 (đktc). Mặt khác, đun nóng 0,12 mol E cần dùng 570 ml dung dịch NaOH 0,5M thu được dung dịch G. Cô cạn dung dịch G thu được hỗn hợp T chứa ba muối có khối lượng m gam và hỗn hợp hai ancol có cùng số nguyên tử cacbon. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Đun nóng 0,12 mol E cần dùng 570 ml dung dịch NaOH 0,5M
Câu 40:
19/07/2024Hòa tan hết m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 vào dung dịch HCl dư, thu được a mol H2 và dung dịch chứa 31,19 gam hỗn hợp muối. Mặt khác, hòa tan hoàn toàn m gam X trong dung dịch chứa 0,55 mol H2SO4 (đặc) đun nóng, thu được dung dịch Y và 0,14 mol SO2 (sản phẩm khử duy nhất của S+6). Cho 400 ml dung dịch NaOH 1M vào Y, sau khi phản ứng kết thúc được 10,7 gam một chất kết tủa. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Bài thi liên quan
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 1)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 2)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 3)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 4)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 5 )
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 6)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 7)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 8)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 9)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 10)
-
40 câu hỏi
-
90 phút
-
