Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (24 đề)
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 12)
-
5361 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 9:
23/07/2024Nước muối sinh lí để sát trùng, rửa vết thương trong y học có nồng độ là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 12:
19/07/2024Ion kim loại X khi vào cơ thể vượt mức cho phép sẽ gây nguy hiểm cho sự phát triển cả về trí tuệ và thể chất con người. Ở các làng nghề tái chế ắc quy cũ, nhiều người bị ung thư, trẻ em chậm phát triển trí tuệ, còi cọc vì nhiễm độc ion kim loại này. Kim loại X là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 13:
19/07/2024Sản phẩm cuối cùng của quá trình thủy phân các protein đơn giản nhờ xúc tác thích hợp là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 14:
19/07/2024Loại tơ nào sau đây thuộc loại tơ tổng hợp?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Tơ lapsan thuộc loại polieste được tổng hợp từ axit telephatalic và etylen glicol.
Có công thức là
Câu 15:
23/07/2024Khi cho dung dịch anbumin tác dụng với Cu(OH)2 thu dung dịch màu
 Xem đáp án
Xem đáp án
Chọn đáp án A
Dung dịch anbumin (lòng trắng trứng) có phản ứng màu biure với Cu(OH)2 cho hợp chất màu tím.
Câu 16:
19/07/2024Hòa tan hoàn toan 0,46 gam một kim loại kiềm vào 20 ml nước, thu được 20,44 gam một dung dịch kiềm. Kim loại kiềm đó là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Ta có: 20 ml nước = 20 gam nước
So sánh chất hết, chất dư ta có kim loại kiềm hết, nước dư.
Bảo toàn khối lượng:
Câu 17:
23/07/2024Kim loại crom tan được trong dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
→ Phương trình phản ứng minh họa là: Fe + 2HCl → FeCl2 + H2
Câu 18:
21/07/2024Cho hình vẽ mô tả thí nghiệm điều chế X khi cho dung dịch axit tác dụng với chất rắn (kim loại hoặc muối).
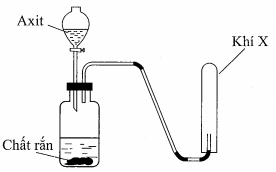
Hình vẽ trên minh họa cho phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích
Al là kim loại có khả năng vừa tan được trong dung dịch axit, vừa tan được trong dung dịch kiềm.
Câu 19:
23/07/2024Ở nhiệt độ thường, kim loại X không tan trong nước nhưng tan trong dung dịch kiềm. Kim loại X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Al là kim loại có khả năng vừa tan được trong dung dịch axit, vừa tan được trong dung dịch kiềm.
Chú ý: Tuy nhiên Al không phải là chất lưỡng tính.
Câu 20:
23/07/2024Ngâm một thanh Fe trong dung dịch CuSO4. Sau một thời gian phản ứng lấy thanh kim loại ra rửa, làm khô, đem cân thầy khối lượng tăng thêm 1,6 gam. Khối lượng Cu bám trên thanh Fe là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Câu 21:
21/07/2024Thủy phân este X có công thức phân tử C4H8O2 trong dung dịch NaOH thu được hỗn hợp hai chất hữu cơ Y và Z trong đó Z có tỉ khối hơi so với H2 là 16. X là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Ta có: Z là CH3OH.
Vậy X là C2H5COOCH3.
Câu 22:
22/07/2024Cho các kim loại sau: Na, Al, Fe, Cu. số kim loại khử được ion trong dung dịch là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Các kim loại khử được ion trong dung dịch là Al, Fe, Cu.
Chú ý: Na có phản ứng nhưng không phải khử , Nạ phản ứng với nước trong dung dịch tạo dung dịch kiềm, sau đó: .
Câu 23:
19/07/2024Thủy phân 200 gam dung dịch saccarozơ 6,84%, sau một thời gian, lấy hỗn hợp sản phẩm cho tác dụng với dung dịch AgNO3 trong NH3 dư, sau phản ứng thu được 12,96 gam Ag. Hiệu suất phản ứng thủy phân là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Câu 24:
19/07/2024Thủy phân hoàn toàn 1 mol peptit mạch hở X, thu được 2 mol Gly, 2 mol Ala và 1 mol Val. Mặt khác, thủy phân không hoàn toàn X, thu được hỗn hợp các amino axit và các peptit (trong đó có Gly-Ala-Val). Số công thức cấu tạo phù hợp với tính chất của X là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Thủy phân hoàn toàn 1 mol peptit mạch hở, thu được 2 mol Gly, 2 mol Ala và 1 mol Val nên X có dạng (Gly)2(Ala)2Val.
Mà khi thủy phân hoàn toàn lại thu được các peptit trong đó có Gly-Ala-Val nên X có thể là:
Gly-Ala-Val-Gly-Ala
Gly-Ala-Val-Ala-Gly
Gly-Gly-Ala-Val-Ala
Ala-Gly-Ala-Val-Gly
Gly-Ala-Gly-Ala-Val
Ala-Gly-Gly-Ala-Val
Câu 25:
19/07/2024Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
A đúng vì tristearin là chất béo no nên ở nhiệt độ thường tồn tại trạng thái rắn.
B sai vì dầu ăn là chất béo nên chứa C, H, O còn dầu mỡ bôi tron chứa C, H.
C đúng vì triolein là chất béo không no nên có khả năng phản ứng cộng hiđro khi đun nóng có xúc tác Ni.
D đúng vì chất béo là este nên bị thủy phân khi đun nóng trong dung dịch kiềm.
Câu 27:
19/07/2024Tiến hành các thí nghiệm sau:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
(a) không thỏa mãn điều kiện xảy ra ăn mòn điện hóa học.
(b) có xảy ra ăn mòn điện hóa học vì xuất hiện cặp điện cực Zn-Fe, tiếp xúc với nhau và trong môi trường dung dịch chất điện li là không khí ẩm.
(c) có xảy ra ăn mòn điện hóa học vì xuất hiện cặp điện cực Fe-Cu, tiếp xúc với nhau và trong môi trường dung dịch chất điện li là H2SO4.
(d) không thỏa mãn điều kiện xảy ra ăn mòn điện hóa học.
Chú ý: Ăn mòn điện hóa học xảy ra khi thỏa mãn các điều kiện sau:
1. Hai điện cực phải khác nhau về bản chất: có thể là cặp giữa hai kim loại, cặp kim loại và phi kim, cặp kim loại và họp chất hóa học.
2. Các điện cực phải tiếp xúc với nhau (trực tiếp hoặc gián tiếp).
3. Các điện cực cùng tiếp xúc với dung dịch chất điện li.
Câu 29:
19/07/2024Đốt cháy hoàn toàn 4,03 gam triglixerit X bằng một lượng O2 vừa đủ, cho toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng nước vôi trong dư, thu được 25,50 gam kết tủa và khối lượng dung dịch thu được giảm 9,87 gam so với dung dịch nước vôi trong ban đầu. Mặt khác, thủy phân hoàn toàn 8,06 gam X trong dung dịch NaOH dư, đun nóng, thu được dung dịch chứa a gam muối. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Câu 30:
23/07/2024Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ba(OH)2 tới dư vào dung dịch FeCl2.
(b) Cho dung dịch KHSO4 vào dung dịch BaCl2.
(c) Sục khí CO2 tới dư vào dung dịch NaAlO2.
(d) Cho kim loại Zn vào lượng dư dung dịch FeCl3.
(e) Sục khí SO2 tới dư vào dung dịch Ca(OH)2.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải Thích:
Phươngitrdnh hóa học:
(a) Ba(OH)2 + FeCl2 → Fe(OH)2 + BaCl2 (b) KHSO4 + BaCl2 → BaSO4 + KCl + HCl
(c) CO2 + NaAlO2 + H2O → Al(OH)3 + NaHCO3 (d) Zn + 2FeCl3 → ZnCl2 + 2FeCl2
(e) + Ca(OH)2 → CaHSO3
Số thí nghiệm thu được kết tủa là: (a), (b), (c).
Câu 31:
20/07/2024Thực hiện hai thí nghiệm sau:
Thí nghiệm 1 : Cho este X có công thức phân tử C5H8O4 tác dụng hoàn toàn với dung dịch NaOH dư, thư được hai muối Y, Z ( ) và ancol T duy nhất.
Thí nghiệm 2: Thủy phân hoàn toàn tinh bột thu được cacbohiđrat Q. Lên men rượu chất Q thu được chất hữu cơ T.
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
A sai vì Y là muối của axit fomic.
B sai vì X có tham gia phản ứng tráng bạc.
C sai vì HO CH2COOH không phải là axit cacboxylic.
D đúng vì .
Câu 32:
19/07/2024Nung nóng hỗn hợp chứa các chất rắn có cùng số mol gồm Al(NO3)3, NaHCO3, Fe(NO3)3, CaCO3 đến khi khối lượng không đổi, thu được chất rắn X. Hòa tan X vào nước dư, thu được dung dịch Y và chất rắn Z. Thổi luồng khí co dư qua chất rắn Z, nung nóng thu được chất rắn T. Các phản ứng xảy ra hoàn toàn. Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Gọi số mol Al(NO3)3, NaHCO3, Fe(NO3)3, CaCO3 bằng nhau và bằng 1 mol.
Hòa tan X vào nước dư:
CaO + H2O → Ca(OH)2
1 1 mol
Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O
0,5 0,5 mol
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
0,5 0,5 0,5 mol
Dung dịch Y: Ca(AlO2)2 và NaOH.
Chất rắn Z: Fe2O3 và CaCO3.
Thổi luồng khí CO dư qua chất rắn Z, nung nóng thu được chất rắn T gồm Fe và CaO.
→ B đúng.
Câu 33:
19/07/2024Hỗn hợp E gồm hai este đơn chức, là đồng phân cấu tạo và đều chứa vòng benzen. Đốt cháy hoàn toàn m gam E cần vừa đủ 8,064 lít khí O2 (ở đktc), thu được 14,08 gam CO2 và 2,88 gam H2O. Đun nóng m gam E với dung dịch NaOH dư thì có tối đa 2,80 gam NaOH phản ứng, thu được dung dịch T chứa 6,62 gam hỗn hợp ba muối. Khối lượng muối của axit cacboxylic trong T là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
→ Ancol đó là C6H5CH2OH.
Dung dịch T chứa ba muối nên E gồm CH3COOC6H5 (0,03 mol) và HCOOCH2C6H5 (0,01 mol).
→ T chứa CH3COONa (0,03 mol); C6H5ONa (0,03 mol); HCOONa (0,01 mol).
→ .
Câu 34:
19/07/2024Tiến hành thí nghiệm điều chế etyl axetat theo các bước sau đây:
Bước 1: Cho 1 ml C2H5OH, 1 ml CHgCOOH và vài giọt dung dịch H2SO4 đặc vào ống nghiệm.
Bước 2: Lắc đều ống nghiệm, đun cách thủy (trong nồi nước nóng) khoảng 8 phút ở .
Bước 3: Làm lạnh, sau đó rót 2 ml dung dịch NaCl bão hòa vào ống nghiệm.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Phương trình hóa học: CH3COOH + C2H5OH CH3COOC2H5 + H2O
Axit H2SO4 đặc là xúc tác, đồng thời do có tính háo nước sẽ làm chuyển dịch cân bằng ở phản ứng este hóa theo chiều thuận → Tăng hiệu suất phản ứng.
Dung dịch NaCl bão hòa làm giảm độ tan của este nên CH3COOC2H5 nổi lên trên. Chú ý, khi làm lạnh thì phản ứng sẽ dừng lại, sản phẩm sẽ không phân hủy.
Phản ứng este hóa xảy ra không hoàn toàn nên vẫn còn axit và ancol dư.
Câu 35:
19/07/2024X là este đơn chức, phân tử chứa hai liên kết π; Y là este no, hai chức (X, Y đều mạch hở). Đốt cháy hoàn toàn 23,16 gam hỗn hợp E chứa X, Y cần dùng 0,96 mol O2. Mặc khác, đun nóng 23,16 gam hỗn hợp E cần dùng 330 ml dung dịch NaOH 1M, thu được một ancol duy nhất và hỗn hợp chứa a gam muối P và b gam muối Q ( ). Tỉ lệ a : b có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích: :
Gọi công thức phân tử và số mol tương ứng của hai este X và Y trong 23,16 gạm E lần lượt là
Mặt khác khi đun nóng với dung dịch NaOH thu được một ancol duy nhất và hai muối nên X là C3H5COOCH3 (0,09 mol) và Y là (COOCH3)2 (0,12 mol).
→ Muối P là (COONa)2 (0,12 mol) và muối Q là C3H5COONa (0,09 mol).
Câu 36:
19/07/2024Điện phân dung dịch chứa 27,52 gam hỗn hợp CuSO4 và NaCl bằng điện cực trơ, màng ngăn xốp đến khi nước bắt đầu điện phân ở cả hai điện cực thì ngắt dòng điện, thu được dung dịch X và V lít khí thoát ra ở hai điện cực (đktc). Cho dung dịch X vào 120 ml dung dịch A12(SO4)3 0,25M. số mol kết tủa thu được phụ thuộc vào số mol được mô tả bởi đồ thị sau:

Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Tại thời điểm: thì kết tủa đã bị hòa tan một phần, khi đó:
Điện phân dung dịch CuSO4 (x mol) và NaCl (y mol).
Câu 37:
19/07/2024Cho hỗn hợp E gồm 0,15 mol chất hữu cơ mạch hở X (C6H13O4N) và 0,20 mol este hai chức Y (C4H6O4) tác dụng hết với dung dịch NaOH vừa đủ, đun nóng. Kết thúc phản ứng, cô cạn dung dịch, thu được hỗn hợp Z gồm hai ancol đơn chức kế tiếp nhau trong dãy đồng đẳng và a gam hỗn hợp ba muối khan (đều có cùng số cacbon trong phân tử, trong đó có hai muối cacboxylic). Biết X chứa chức este. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Y là (COOCH3)2 có số mol là 0,2 mol.
→ Khi Y tác dụng với dung dịch NaOH thì ancol đơn thức thu được là CH3OH.
→ Hỗn hợp Z gồm CH3OH và C2H5OH.
Khi Y tác dụng với NaOH thu được muối là (COONa)2.
Mặt khác, sau phản ứng thu được ba muối khan có cùng số c trong phân tử nên công thức cấu tạo phù hợp với X là: CH3COONH3CH2COOC2H5.
→ Ba muối thu được là CH3COONa (0,15 mol); H2NCH2COONa (0,15 mol); (COONa)2 (0,2 mol).
→ .
Câu 38:
19/07/2024Cho hỗn hợp X gồm , Fe, MgO, Mg. Cho m gam hỗn hợp X trên tác dụng với dung dịch HNO3 dư, thu được 6,72 lít hỗn hợp khí N2O và NO (đktc) có tỉ khôi hơi so với H2 là 15,933 và dung dịch Y. Cô cạn dung dịch Y thu được 129,4 gam muối khan. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc, nóng, dư, thu được 15,68 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch Z. Cô cạn dung dịch Z thu được 104,0 gam muối khan. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Quy đổi hỗn hợp X gồm Fe (a mol), Mg (b mol) và O (c mol).
Câu 39:
19/07/2024Đốt cháy hoàn toàn a mol chất hữu cơ X (chứa C, H, O) thu được X mol CO2 và y mol H2O với . Hiđro hóa hoàn toàn 0,2 mol X thu được 43,2 gam chất hữu cơ Y. Đun nóng Y với dung dịch NaOH vừa đủ, cô cạn dung dịch sau phản ứng thu được hỗn họp E chứa hai muối natri của hai axit cacboxylic có cùng số nguyên tử c và phần hơi chứa ancol Z. Đốt cháy toàn bộ E thu được CO2, 12,6 gam H2O và 31,8 gam Na2CO3. số nguyên tử H có trong phân tử X là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Trong đó (0,2 mol) và (0,2 mol).
→ Số nguyên tử H (trong ) + Số nguyên tử H (trong ) = 7
Mà hai muối đều no, có cùng số nguyên tử H nên hai muối là C2H5COONa (0,2 mol) và CH2(COONa)2 (0,2 mol).
Ta có: → Công thức của Y là CH2(COO)2C3H5OOCC2H5.
Lại có: X có nên công thức của X là CH2(COO)2C3H5OOCC ≡ CH.
→ Số nguyên tử H trong X là 8.
Câu 40:
21/07/2024Cho 12,48 gam X gồm Cu và Fe tác dụng hết với 0,15 mol hỗn họp khí gồm Cl2 và O2, thu được chất rắn Y gồm các muối và oxit. Hòa tan vừa hết Y cần dùng 360 ml dung dịch HCl 1M, thu được dung dịch Z. Cho dung dịch AgNO3 dư vào Z, thu được 75,36 gam chất rắn. Mặt khác, hòa tan hết 12,48 gam X trong dung dịch HNO3 nồng độ 31,5%, thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất của , ở đktc). Nồng độ phần trăm của Fe(NO3)3 trong dung dịch T là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Cho 12,48 gam X gồm Cu và Fe tác dụng hết với 0,15 mol hỗn hợp khí gồm Cl2 và O2:
→ Muối sắt sau phản ứng gồm cả muối Fe(II) (x mol) và muối Fe(III) (y mol).
Bài thi liên quan
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 1)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 2)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 3)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 4)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 5 )
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 6)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 7)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 8)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 9)
-
40 câu hỏi
-
90 phút
-
-
Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (đề 10)
-
40 câu hỏi
-
90 phút
-
