Giải bài tập trang 14 Chuyên đề Hóa 10 Bài 1 - Cánh diều
Với giải bài tập trang 14 Chuyên đề Hóa 10 trong Bài 1: Liên kết hóa học và hình học phân tử sách Chuyên đề Hóa lớp 10 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Chuyên đề Hóa 10 trang 14.
Giải bài tập trang 14 Chuyên đề Hóa 10 - Cánh diều
Bài tập 1 trang 14 Chuyên đề Hóa 10: Viết công thức Lewis của CF4, C2H6, C2H4 và C2H2.
Trả lời:
- Công thức Lewis của CF4
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử CF4.
C có 4 electron hóa trị, F có 7 electron hóa trị. Trong phân tử CF4 có 1 nguyên tử C và 4 nguyên tử F. Vậy N1 = 1.4 + 4.7 = 32 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
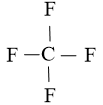
Số electron hóa trị đã dùng để xây dựng khung là N2 = 4.2 = 8 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 32 – 8 = 24 electron
Bước 3: Sử dụng 24 electron này để tạo octet cho F trước (vì F có độ âm điện cao hơn)
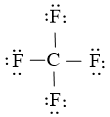
Bước 4: Nguyên tử C đã được octet. Vậy công thức Lewis của CF4 là
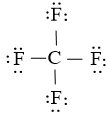
- Công thức Lewis của C2H6
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử C2H6.
C có 4 electron hóa trị, H có 1 electron hóa trị. Trong phân tử C2H6 có 2 nguyên tử C và 6 nguyên tử H. Vậy N1 = 2.4 + 6.1 = 14 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
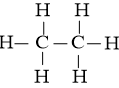
Số electron hóa trị đã dùng để xây dựng khung là N2 = 7.2 = 14 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 14 – 14 = 0 electron
Bước 3: Nguyên tử C và H đều đã được octet. Vậy công thức Lewis của C2H6 là
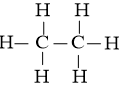
- Công thức Lewis của C2H4
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử C2H4:
C có 4 electron hóa trị, H có 1 electron hóa trị. Trong phân tử C2H4, có 2 nguyên tử C và 4 nguyên tử H. Vậy N1 = 2.4 + 4.1 = 12 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử.
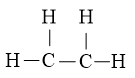
Số electron hóa trị đã dùng để xây dựng khung là N2 = 5.2 = 10 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 12 – 10 = 2 electron
Bước 3: Sử dụng N3 = 2 electron để tạo octet cho C trước
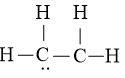
Bước 4: Đã sử dụng hết 2 electron để tạo octet cho C. Tuy nhiên C còn lại chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử C vừa được tạo octet tạo thành cặp electron dùng chung giữa hai nguyên tử C. Các nguyên tử H đã đủ octet. Vậy công thức Lewis của C2H4 là
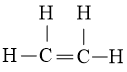
- Công thức lewis của C2H2
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử C2H2:
C có 4 electron hóa trị, H có 1 electron hóa trị. Trong phân tử C2H2, có 2 nguyên tử C và 2 nguyên tử H. Vậy N1 = 2.4 + 2.1 = 10 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
![]()
Số electron hóa trị đã dùng để xây dựng khung là N2 = 3.2 = 6 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 10 – 6 = 4 electron
Bước 3: Sử dụng N3 = 4 electron để tạo octet cho một C trước
![]()
Bước 4: Đã sử dụng hết 4 electron để tạo octet cho một C. Tuy nhiên C còn lại chưa đủ octet nên ta chuyển 2 cặp electron của nguyên tử C vừa được tạo octet tạo thành cặp electron dùng chung giữa hai nguyên tử C. Các nguyên tử H đã được octet.
Vậy công thức Lewis của C2H2 là
![]()
Bài tập 2 trang 14 Chuyên đề Hóa 10: Viết công thức Lewis của H2O. Dự đoán dạng hình học phân tử và dạng lai hóa của nguyên tử trung tâm.
Trả lời:
- Công thức Lewis của H2O
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử H2O:
O có 6 electron hóa trị, H có 1 electron hóa trị. Trong phân tử H2O, có 2 nguyên tử H và 1 nguyên tử O. Vậy N1 = 2.1 + 1.6 = 8 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
![]()
Số electron hóa trị đã dùng để xây dựng khung là N2 = 2.2 = 4 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 8 – 4 = 4 electron
Bước 3: Sử dụng N3 = 4 electron để tạo octet cho O. Các nguyên tử H đã được octet.
Công thức Lewis của H2O là
![]()
- Dự đoán hình dạng phân tử và dạng lai hóa của nguyên tử trung tâm O
Xung quanh nguyên tử trung tâm O có 4 đám mây E (hai cặp electron chưa liên kết và hai cặp electron chung), do lực đẩy giữa các đám mây nên 4 đám mây E này phải có vị trí xa nhau nhất ⇒ 4 đám mây hướng về 4 đỉnh của một hình tứ diện đều.
⇒ Dự đoán phân tử nước có cấu tạo góc (góc liên kết 109,5o); nguyên tử trung tâm O ở dạng lai hóa sp3:
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
2 AO lai hóa sp3 chứa electron độc thân của nguyên tử O xen phủ với 2 AO s của nguyên tử H tạo thành 2 liên kết σ.
Chú ý:
Do cặp electron chưa liên kết chiếm khoảng không gian lớn hơn so với các cặp electron liên kết, tương tác đẩy giữa các cặp electron chưa liên kết lớn hơn tương tác đẩy giữa các cặp electron liên kết, nên góc liên kết thực tế bằng 104,5o, nhỏ hơn góc hóa trị theo lí thuyết (109,5o).
Bài tập 3 trang 14 Chuyên đề Hóa 10: Dựa theo công thức Lewis của CHCl3 xác định được dạng lai hóa của nguyên tử trung tâm C trong phân tử này là
A. sp B. sp2 C. sp3
Trả lời:
Đáp án đúng là: C
Công thức Lewis của CHCl3 là
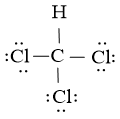
Nguyên tử trung tâm C có 4 liên kết đơn xung quanh tương ứng với 4 đám mây electron. Công thức VSEPR của CHCl3 là AE4
Do 4 đám mây hướng tới 4 đỉnh của một tứ diện nên dạng hình học không gian của CHCl3 có dạng tứ diện
⇒ Trạng thái lai hóa của nguyên tử C trong phân tử CHCl3 là sp3.
Bài tập 4* trang 14 Chuyên đề Hóa 10: Xác định công thức Lewis của nitric acid (HNO3). Cho biết nguyên tử H liên kết với O mà không phải với N.
Trả lời:
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử HNO3:
N có 5 electron hóa trị, O có 6 electron hóa trị, H có 1 electron hóa trị. Trong phân tử HNO3, có 1 nguyên tử H, 3 nguyên tử O và 1 nguyên tử N
⇒ Tổng số electron hóa trị N1 = 1.1 + 3.6 + 1.5 = 24 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
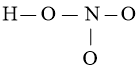
Số electron hóa trị đã dùng để xây dựng khung là N2 = 4.2 = 8 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 24 – 8 = 16 electron
Bước 3: Sử dụng N3 = 16 electron để tạo octet cho O trước
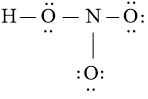
Bước 4: Đã sử dụng hết 16 electron để tạo octet cho O. Tuy nhiên N chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O (không liên kết với H) tạo thành cặp electron dùng chung cho hai nguyên tử O và N
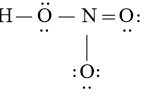
Bài tập 5* trang 14 Chuyên đề Hóa 10: Viết công thức Lewis và xác định dạng hình học của CS2. Xác định dạng lai hóa của nguyên tử trung tâm C trong phân tử này.
Trả lời:
Công thức Lewis của CS2
![]()
Xung quanh nguyên tử C có hai đám mây electron hóa trị, do lực đẩy giữa 2 đám mây electron nên 2 đám mây này phải xa nhau nhất → CS2 có dạng đường thẳng theo mô hình VSEPR.
Bài tập 6* trang 14 Chuyên đề Hóa 10: Viết công thức Lewis của PCl5 và SF6
Trả lời:
Công thức Lewis của PCl5:
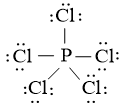
Công thức Lewis của SF6:
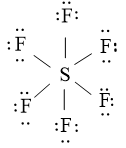
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều với cuộc sống hay, chi tiết khác:
Giải bài tập trang 6 Chuyên đề Hóa 10 Bài 1
Giải bài tập trang 8 Chuyên đề Hóa 10 Bài 1
Giải bài tập trang 9 Chuyên đề Hóa 10 Bài 1
Giải bài tập trang 10 Chuyên đề Hóa 10 Bài 1
Giải bài tập trang 11 Chuyên đề Hóa 10 Bài 1
Giải bài tập trang 12 Chuyên đề Hóa 10 Bài 1
Giải bài tập trang 13 Chuyên đề Hóa 10 Bài 1
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều hay, chi tiết khác:
Câu hỏi 1 trang 6 Chuyên đề Hóa 10: Những electron như thế nào được gọi là: a) Electron hóa trị...
Câu hỏi 2 trang 6 Chuyên đề Hóa 10: Viết công thức cấu tạo của CO2 và H2O...
Luyện tập 1 trang 8 Chuyên đề Hóa 10: Viết công thức Lewis của CH4, BF3, SO3 và F2O...
Câu hỏi 3 trang 9 Chuyên đề Hóa 10: Các điện tích cùng dấu thì đẩy nhau hay hút nhau...
Luyện tập trang 10 Chuyên đề Hóa 10: Viết công thức Lewis, dự đoán dạng hình học của phân tử CH4...
Bài tập 1 trang 14 Chuyên đề Hóa 10: Viết công thức Lewis của CF4, C2H6, C2H4 và C2H2...
Bài tập 6* trang 14 Chuyên đề Hóa 10: Viết công thức Lewis của PCl5 và SF6...
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 3: Năng lượng hoạt hóa của phản ứng hóa học
Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều
