Viết công thức Lewis của CH4, BF3, SO3 và F2O
Lời giải Luyện tập 1 trang 8 Chuyên đề Hóa 10 sách Chuyên đề Hóa học lớp 10 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập.
Giải Chuyên đề Hóa 10 Cánh diều Bài 1: Liên kết hóa học và hình học phân tử
Luyện tập 1 trang 8 Chuyên đề Hóa 10: Viết công thức Lewis của CH4, BF3, SO3 và F2O
Trả lời:
- Công thức Lewis của CH4:
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử CH4
Carbon có 4 electron hóa trị, hydrogen có 1 electron hóa trị. Trong CH4 có 1 nguyên tử carbon và 4 nguyên tử hydrogen. Vậy N1 = 1.4 + 4.1 = 8 (electron).
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
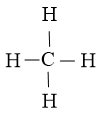
Số electron hóa trị đã dùng để xây dựng khung là N2 = 4.2 = 8 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 8 – 0 = 0
Vậy công thức Lewis của CH4 là
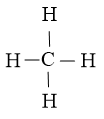
- Công thức Lewis của BF3
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử BF3
Boron có 3 electron hóa trị, fluorine có 7 electron hóa trị. Trong phân tử BF3 có 1 nguyên tử boron và 3 nguyên tử fluorine. Vậy N1 = 1.3 + 3.7 = 24 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
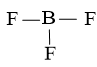
Số electron hóa trị đã dùng để xây dựng khung là N2 = 3.2 = 6 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 24 – 6 = 18 electron
Bước 3: Sử dụng 18 electron này để tạo octet cho F trước (vì F có độ âm điện cao hơn)
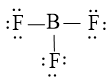
Bước 4: Nguyên tử B chưa được octet nên ta chuyển 1 cặp electron chưa liên kết của F tạo cặp electron chung
Vậy công thức Lewis của BF3
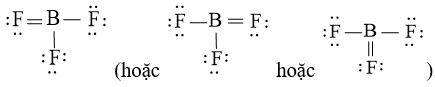
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử SO3
Sulfur có 6 electron hóa trị, oxygen có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O. Vậy N1 = 1.6 + 3.6 = 24 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
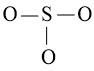
Số electron hóa trị đã dùng để xây dựng khung là N2 = 3.2 = 6 electron
Số electron hóa trị còn lại là N3 = N1 – N2 = 24 – 6 = 18 electron
Bước 3: Sử dụng N3 = 18 electron để tạo octet cho O trước (do O có độ âm điện lớn hơn)
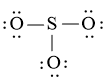
Bước 4: Đã sử dụng hết 18 electron để tạo octet cho O. Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O bên trái tạo thành cặp electron dùng chung.
chung.
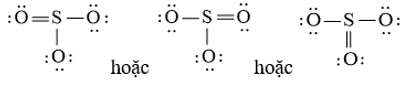
- Công thức Lewis của F2O
Bước 1: Tính tổng số electron hóa trị (N1) của phân tử OF2
Flourine có 7 electron hóa trị, oxygen có 6 electron hóa trị. Trong phân tử F2O có hai nguyên tử F và 1 nguyên tử O nên
⇒ Tổng số electron hóa trị N1 = 2.7 + 1.6 = 20 electron
Bước 2: Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử:
![]()
Số electron hóa trị đã dùng để xây dựng khung là N2 = 2.2 = 4 electron
Số electron hóa trị còn lại là N3 = 20 – 4 = 16 electron
Bước 3: Sử dụng N3 = 16 electron để tạo octet cho F trước, sau đó tạo octet cho O.
Vậy công thức Lewis của F2O là
![]()
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều hay, chi tiết khác:
Câu hỏi 1 trang 6 Chuyên đề Hóa 10: Những electron như thế nào được gọi là: a) Electron hóa trị...
Câu hỏi 2 trang 6 Chuyên đề Hóa 10: Viết công thức cấu tạo của CO2 và H2O...
Luyện tập 1 trang 8 Chuyên đề Hóa 10: Viết công thức Lewis của CH4, BF3, SO3 và F2O...
Câu hỏi 3 trang 9 Chuyên đề Hóa 10: Các điện tích cùng dấu thì đẩy nhau hay hút nhau...
Luyện tập trang 10 Chuyên đề Hóa 10: Viết công thức Lewis, dự đoán dạng hình học của phân tử CH4...
Bài tập 1 trang 14 Chuyên đề Hóa 10: Viết công thức Lewis của CF4, C2H6, C2H4 và C2H2...
Bài tập 6* trang 14 Chuyên đề Hóa 10: Viết công thức Lewis của PCl5 và SF6...
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 3: Năng lượng hoạt hóa của phản ứng hóa học
Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều
