TOP 14 câu Trắc nghiệm KHTN 8 Bài 5 (Cánh diều 2024) có đáp án: Tính theo phương trình hóa học
Bộ 14 câu hỏi trắc nghiệm Khoa học tự nhiên lớp 8 Bài 5: Tính theo phương trình hóa học có đáp án đầy đủ các mức độ sách Cánh diều giúp học sinh ôn luyện trắc nghiệm KHTN 8 Bài 5.
Trắc nghiệm KHTN 8 Bài 5: Tính theo phương trình hóa học
Câu 1: Cho sơ đồ phản ứng sau:
Zn + HCl ZnCl2 + H2
Sau phản ứng thu được 7,437 lít (đkc) khí hydrogen thì khối lượng của Zn đã tham gia phản ứng là
A. 13,0 gam.
B. 15,9 gam.
C. 19,5 gam.
D. 26,0 gam.
Đáp án đúng là: C
Số mol H2 thu được là:
Số mol H2 thu được là:
PTHH: Zn + 2HCl →ZnCl2 + H2
Tỉ lệ phản ứng:11
Đề bài:0,3←0,3 (mol)
Vậy khối lượng của Zn là 0,3×65 = 19,5 gam.
Câu 2: Nếu đốt 12,0 gam carbon trong khí oxygen dư thu được 39,6 gam CO2 thì hiệu suất phản ứng là
A. 80%.
B. 85%.
C. 95%.
D. 90%..
Đáp án đúng là: D
PTHH: C + O2 → CO2
Tỉ lệ phản ứng:11
Đề bài:0,9←0,9(mol)
Hiệu suất phản ứng là
Câu 3: Trộn 4 gam bột sulfur với 14 gam bột sắt rồi nung nóng trong điều kiện không có không khí. Khối lượng FeS thu được sau phản ứng là
A. 18 gam.
B. 11,0 gam.
C. 16 gam.
D. 13 gam.
Đáp án đúng là: B
|
|
|
|
|
Fe+S FeS |
||
|
Tỉ lệ phản ứng: |
111 |
(mol) |
|
Đề bài: |
0,250,125 |
(mol) |
|
Tỉ lệ: |
> |
|
|
Fe dưS hết |
||
|
Phản ứng: |
0,125 0,125 |
(mol) |
mFeS = n.M = 0,125.88 = 11,0 (g)
Câu 4: Đốt cháy hoàn toàn 7,5 gam than đá (biết than đá có thành phần chính là carbon, chứa 4% tạp chất không cháy) thu được CO2. Thể tích khí oxi cần dùng (đkc) để đốt cháy hết lượng than đá trên là
A. 15,29 lít.
B. 67,2 lít.
C. 33,6 lít.
D. 14,874 lít.
Đáp án đúng là: D
Khối lượng carbon nguyên chất trong 7,5 gam than đá là:
mC =
|
C + O2 CO2 |
||
|
Tỉ lệ phản ứng: |
1 1 |
(mol) |
|
Phản ứng: |
0,6 0,6 |
(mol) |
Câu 5: Cho hỗn hợp X (chứa 2,3 gam sodium và 1,95 gam potassium) tác dụng hết với nước, thu được khí hydrogen và dung dịch chứa NaOH và KOH. Thể tích khí hydrogen thu được (đkc) là
A. 3,7185 lít.
B. 1,85925 lít.
C. 1,7353 lít.
D. 2,6848 lít.
Đáp án đúng là: C
|
2Na+ 2H2O 2NaOH+H2 |
||
|
Tỉ lệ phản ứng: |
21 |
(mol) |
|
Phản ứng: |
0,10,05 |
(mol) |
|
2K+2H2O 2KOH+H2 |
||
|
Tỉ lệ phản ứng: |
21 |
(mol) |
|
Phản ứng: |
0,050,025 |
(mol) |
Câu 6: Cho sơ đồ phản ứng sau:
Al + HCl AlCl3 + H2
Sau phản ứng thu được 7,437 lít (đkc) khí hydrogen thì số mol của Al đã tham gia phản ứng là
A. 0,3 mol.
B. 0,2 mol.
C. 0,1 mol.
D. 0,15 mol.
Đáp án đúng là: B
Số mol khí hydrogen là:
PTHH:2Al + 6HCl → 2AlCl3 + 3H2
Tỉ lệ phản ứng:23
Đề bài:0,2←0,3(mol)
Số mol của Al đã tham gia phản ứng là 0,2 mol.
Câu 7: Cho phương trình hóa học nhiệt phân muối calcium carbonate:
Số mol CaCO3 cần dùng để điều chế được 0,2 mol CaO là
A. 0,2 mol.
B. 0,3 mol.
C. 0,4 mol.
D. 0,1 mol.
Đáp án đúng là: A
PTHH:
Tỉ lệ phản ứng:11
Đề bài:0,2←0,2(mol)
Vậy số mol CaCO3 cần dùng để điều chế được 0,2 mol CaO là 0,2 mol.
Câu 8: Một nhà máy dự tính sản xuất 100 tấn NH3 từ N2 và H2 trong điều kiện thích hợp. Tuy nhiên, khi đưa vào quy trình sản xuất thực tế chỉ thu được 25 tấn NH3. Hiệu suất của phản ứng sản xuất NH3 nói trên là
A. 4,0% gam.
B. 25,0%.
C. 40%.
D. 2,5 %.
Đáp án đúng là: B
Hiệu suất phản ứng là
Câu 9: Cho phương trình hóa học sau:
Thể tích khí O2 (đkc) thu được khi nhiệt phân hoàn toàn 1 mol KMnO4 là
A. 24,79 lít.
B. 12,395 lít.
C. 49,58 lít.
D. 11,2 lít.
Đáp án đúng là: B
PTHH:
Tỉ lệ phản ứng:21
Đề bài:1←0,5(mol).
Số mol oxygen thu được là 0,5 mol
Thể tích khí O2 (đkc) thu được là: 0,5.24,79 = 12,395 (lít).
Câu 10: Một nhà máy dự tính sản xuất 80 tấn vôi sống CaO từ đá vôi. Tuy nhiên, khi đưa vào quy trình sản xuất thực tế chỉ thu được 25 tấn CaO. Hiệu suất của quá trình nói trên là
A. 25,0% gam.
B. 31,25%.
C. 32,0%.
D. 30,5 %.
Đáp án đúng là: B
Hiệu suất phản ứng là
Câu 11: Cho phương trình hóa học sau:
Số mol Fe cần dùng để điều chế được 2 mol iron(III) chloride là
A. 2 mol.
B. 3 mol.
C. 1 mol.
D. 1,5 mol.
Đáp án đúng là: A
PTHH:
Tỉ lệ phản ứng: 22
Đề bài: 2←2(mol)
Vậy số mol Fe cần dùng là 2 mol.
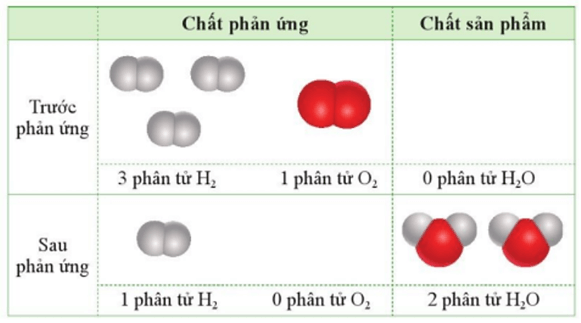
Câu 12: Cho 3 phân tử H2 tác dụng với 1 phân tử O2 (trong điều kiện thích hợp):
Chọn phát biểu đúng trong những phát biểu dưới đây?
A. Sau khi phản ứng xảy ra hoàn toàn, chỉ thu được 2 phân tử nước, không còn phân tử H2 và O2.
B. Sau khi phản ứng xảy ra hoàn toàn, thu được 2 phân tử nước và còn 1 phân tử H2 dư.
C. Sau khi phản ứng xảy ra hoàn toàn, thu được 2 phân tử nước và còn 1 phân tử O2 dư.
D. Sau khi phản ứng xảy ra hoàn toàn, thu được 1 phân tử nước và còn 1 phân tử H2 dư.
Đáp án đúng là: B
Phát biểu đúng là “Sau khi phản ứng xảy ra hoàn toàn, thu được 2 phân tử nước và còn 1 phân tử H2 dư”.
Câu 13: Đốt 32,0 gam sulfur trong khí oxygen dư, tính khối lượng SO2 thu được nếu hiệu suất phản ứng đạt 80%.
A. 64 gam.
B. 80 gam.
C. 51,2 gam.
D. 52,1 gam.
Đáp án đúng là: C
Số mol sulfur tham gia phản ứng là:
PTHH:S + O2 → SO2
Tỉ lệ phản ứng:11
Đề bài:0,8 →0,8 (mol)
Vậy khối lượng SO2 thu được là: 0,8 ×64 = 51,2 (gam).
Câu 14: Cho kim loại sắt tác dụng với dung dịch H2SO4 loãng, thu được FeSO4 và khí hydrogen. Nếu dùng 5,6 gam sắt thì số mol H2SO4 cần để phản ứng là bao nhiêu?
A. 0,1 mol.
B. 1 mol.
C. 0,2 mol.
D. 0,3 mol.
Đáp án đúng là: A
Số mol sắt là:
PTHH: Fe + H2SO4 → FeSO4 + H2
Tỉ lệ phản ứng:1 →1
Đề bài:0,1 →0,1(mol)
Vậy số mol H2SO4 cần dùng là 0,1 (mol).
Xem thêm câu hỏi trắc nghiệm Khoa học tự nhiên lớp 8 Cánh diều có đáp án hay khác:
Trắc nghiệm Bài 6: Nồng độ dung dịch
Xem thêm các chương trình khác:
- Trắc nghiệm Địa lí 8 Kết nối tri thức có đáp án
- Trắc nghiệm Toán lớp 8 Kết nối tri thức có đáp án
- Trắc nghiệm Lịch sử 8 Kết nối tri thức có đáp án
- Trắc nghiệm GDCD 8 Kết nối tri thức có đáp án
- Trắc nghiệm Địa lí 8 Chân trời sáng tạo có đáp án
- Trắc nghiệm Toán lớp 8 Chân trời sáng tạo có đáp án
- Trắc nghiệm Lịch sử 8 Chân trời sáng tạo có đáp án
- Trắc nghiệm GDCD 8 Chân trời sáng tạo có đáp án