SBT Khoa học tự nhiên 7 Bài 6 (Chân trời sáng tạo): Giới thiệu về liên kết hóa học
Với giải sách bài tập Khoa học tự nhiên lớp 7 Bài 6: Giới thiệu về liên kết hóa học sách Chân trời sáng tạo hay nhất, ngắn gọn sẽ giúp học sinh dễ dàng làm bài tập trong SBT KHTN 7 Bài 6.
Giải sách bài tập KHTN 7 Bài 6: Giới thiệu về liên kết hóa học - Chân trời sáng tạo
Giải SBT Khoa học tự nhiên 7 trang 18
Bài 6.1 trang 18 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Tất cả các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng.
B. Vỏ nguyên tử của các nguyên tố khí hiếm đều có cùng số lớp electron.
C. Các nguyên tố khí hiếm đều rất khó hoặc không kết hợp với nguyên tố khác thành hợp chất.
D. Hợp chất tạo bởi các nguyên tố khí hiếm đều ở thể khí.
Lời giải:
Đáp án đúng là: C
A sai vì He là khí hiếm chỉ có 2 electron ở lớp ngoài cùng.
B sai vì số lớp electron của các khí hiếm là khác nhau.
D sai vì khí hiếm gần như không kết hợp với các nguyên tố khác tạo hợp chất.
A. nhường các electron ở lớp ngoài cùng.
B. nhận thêm electron vào lớp electron ngoài cùng.
C. nhường electron hoặc nhận electron để lớp electron ngoài cùng đạt trạng thái bền (có 8 electron).
D. nhường electron hoặc nhận electron hoặc góp chung electron.
Lời giải:
Đáp án đúng là: D
Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của nguyên tố có khuynh hướng nhường electron hoặc nhận electron hoặc góp chung electron.
Bài 6.3 trang 18 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng.
D. Để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
Lời giải:
Đáp án đúng là: D
Để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
A, B sai vì nguyên tử của nguyên tố phi kim không tạo ion dương.
C sai vì nguyên tử của nguyên tố kim loại chỉ nhường electron.
Bài 6.4 trang 18 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Nguyên tố tạo ion âm đều là nguyên tố phi kim.
B. Nguyên tố tạo ion dương có thể là nguyên tố kim loại hoặc nguyên tố phi kim.
C. Để tạo ion dương thì nguyên tố phi kim sẽ nhường electron.
D. Để tạo ion âm thì nguyên tố kim loại sẽ nhận electron.
Lời giải:
Đáp án đúng là: A
B sai vì nguyên tố kim loại không tạo ion âm.
C sai vì nguyên tố phi kim không nhường electron.
D sai vì nguyên tố kim loại không nhận electron.
Bài 6.5 trang 18 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Để tạo ion âm thì nguyên tử của nguyên tố phi kim sẽ nhường electron ở lớp ngoài cùng.
D. Để tạo ion âm thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
Lời giải:
Đáp án đúng là: B
A sai vì nguyên tố phi kim nhận electron.
C sai vì nguyên tố kim loại không nhận thêm electron.
D sai vì nguyên tử của nguyên tố hóa học nhường electron sẽ tạo thành ion dương.
Giải SBT Khoa học tự nhiên 7 trang 19
Bài 6.6 trang 19 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây không đúng?
A. Liên kết trong các phân tử đơn chất thường là liên kết cộng hóa trị.
C. Liên kết giữa các nguyên tố phi kim thường là liên kết cộng hóa trị.
D. Liên kết giữa các nguyên tố kim loại với nguyên tố phi kim đều là liên kết ion.
Lời giải:
Đáp án đúng là: D
D sai vì có một số trường hợp đặc biệt liên kết giữa nguyên tố kim loại với nguyên tố phi kim là liên kết cộng hóa trị vú dụ AlCl3.
Bài 6.7 trang 19 SBT Khoa học tự nhiên 7: Ở điều kiện thường, phát biểu nào sau đây là đúng?
A. Tất cả các hợp chất ở thể rắn đều là chất ion.
B. Chất cộng hóa trị luôn ở thể rắn.
C. Chất chỉ có liên kết cộng hóa trị là chất cộng hóa trị và luôn ở thể khí.
D. Hợp chất có chứa kim loại thường là chất ion.
Lời giải:
Đáp án đúng là: D
A sai vì hợp chất cộng hóa trị cũng ở thể rắn, ví dụ đường, iodine…
B, C sai vì hợp chất cộng hóa trị có thể ở thể rắn, thể lỏng hoặc thể khí.
Bài 6.8 trang 19 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây không đúng?
A. Hợp chất chỉ có liên kết cộng hóa trị là chất cộng hóa trị.
B. Hợp chất chỉ có liên kết ion là chất ion.
C. Một số hợp chất có cả liên kết ion và liên kết cộng hóa trị.
D. Ở điều kiện thường, hợp chất ở thể rắn là chất ion.
Lời giải:
Đáp án đúng là: D
Đáp án D không đúng, vì hợp chất ở thể rắn có thể là chất cộng hóa trị (đường, paraffin, …)
Bài 6.9 trang 19 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Hợp chất ion và chất cộng hóa trị đều bền với nhiệt.
B. Hợp chất ion và chất cộng hóa trị đều tan tốt trong nước.
C. Khi các chất ion và chất cộng hóa trị tan trong nước đều tạo dung dịch có khả năng dẫn điện được.
D. Các chất ion luôn ở thể rắn.
Lời giải:
Đáp án đúng là: D
A sai vì một số hợp chất cộng hóa trị kém bền với nhiệt.
B sai vì nhiều hợp chất khó tan hoặc không tan trong nước.
C sai vì có hợp chất tan trong nước tạo dung dịch không có khả năng dẫn điện.
Bài 6.10 trang 19 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
(a) Tất cả các chất ion đều ở thể rắn.
(b) Tất cả các chất ion đều tan trong nước và tạo thành dung dịch có khả năng dẫn điện.
(c) Khi đun sodium chloride rắn ở nhiệt độ cao sẽ được sodium chloride lỏng, dẫn điện.
(d) Đường tinh luyện và muối ăn đều là chất rắn tan được trong nước tạo dung dịch dẫn điện.
Lời giải:
Đáp án đúng là: C
(d) sai vì dung dịch nước đường không dẫn điện.
Giải SBT Khoa học tự nhiên 7 trang 20
Bài 6.11 trang 20 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
a) Ở điều kiện thường, các chất ion đều ở thể rắn.
b) Ở điều kiện thường, các hợp chất ở thể lỏng đều là chất cộng hóa trị.
d) Hợp chất chỉ gồm các nguyên tố phi kim thường dễ bay hơi, kém bền với nhiệt.
e) Hợp chất tan được trong nước thành dung dịch không dẫn điện thường là chất cộng hóa trị.
Lời giải:
Cả 5 phát biểu đều đúng.
Bài 6.12 trang 20 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
a) Trong hợp chất, kim loại luôn nhường electron, phi kim luôn nhận electron.
c) Liên kết trong hợp chất tạo bởi magnesium và chlorine là liên kết ion.
d) Trong phân tử, hợp chất gồm các nguyên tố C, H, O chỉ có liên kết cộng hóa trị.
e) Khi tạo liên kết hóa học, nguyên tử chlorine chỉ tạo ion âm bằng cách nhận thêm 1 electron.
Lời giải:
Đáp án đúng là: B
Các phát biểu đúng là (c); (d).
a) Để tạo ion dương thì (1) …. sẽ (2) ….. Số electron (3) …. bằng (4) ….
b) Để tạo ion âm thì (5) … sẽ (6) …. Số electron (7) … bằng (8) ….
Lời giải:
a) Để tạo ion dương thì (1) kim loại sẽ (2) nhường electron. Số electron (3) nhường bằng (4) số electron lớp ngoài cùng.
b) Để tạo ion âm thì (5) phi kim sẽ (6) nhận electron. Số electron (7) nhận bằng (8) 8 – số electron lớp ngoài cũng.
a) Chất ion luôn chứa nguyên tố (1)…., ở điều kiện thường luôn ở (2)…
Lời giải:
a) Chất ion luôn chứa nguyên tố (1) kim loại, ở điều kiện thường luôn ở (2) thể rắn.
b) Ở điều kiện thường, chất ở thể khí luôn là (3) chất cộng hóa trị. Chất này có thể (4) tan được trong nước, tạo dung dịch có khả năng (5) dẫn điện hoặc không dẫn điện.

Lời giải:
- Các ứng dụng khác của magnesium oxide: Xử lí đất, nước ngầm, xử lí nước thải, xử lí nước uống bằng cách ổn định độ pH. Magnesium oxide còn được sử dụng làm thuốc dịu cơn đau, ợ nóng và chua của chứng đau dạ dày, khó tiêu, ổn định tính acid của dạ dày,…
- Sơ đồ hình thành liên kết tạo ra phân tử magnesium oxide:
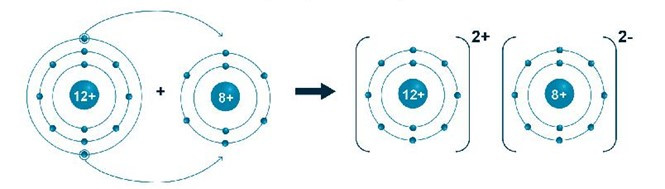
- Khối lượng phân tử magnesium oxide = 24 + 16 = 40 (amu).
Giải SBT Khoa học tự nhiên 7 trang 21
Lời giải:
Chất khó bay hơi, khó nóng chảy, dễ tan trong nước tạo dung dịch dẫn được điện là chất ion.
Ví dụ hai chất có tính chất trên là:
+ Muối ăn (sodium chloride, NaCl) gồm 1 nguyên tử Na và 1 nguyên tử Cl.
+ Calcium chloride (CaCl2) gồm 1 nguyên tử Ca và 2 nguyên tử Cl.

Lời giải:
Phân tử acetic acid là chất cộng hóa trị do phân tử gồm các nguyên tố phi kim, điều kiện thường ở thể lỏng.
Khối lượng phân tử acetic acid là: 12 . 2 + 1 . 4 + 16 . 2 = 60 (amu).
Lời giải:
Chất (A) có khối lượng phân tử > 30 amu, thể khí, là nguyên nhân gây ra hiệu ứng nhà kính vậy (A) là carbon dioxide.
Carbon dioxide thể khí, được tạo thành từ các nguyên tử phi kim liên kết trong phân tử carbon dioxide là liên kết cộng hóa trị.
Sơ đồ hình thành liên kết trong phân tử carbon dioxide:
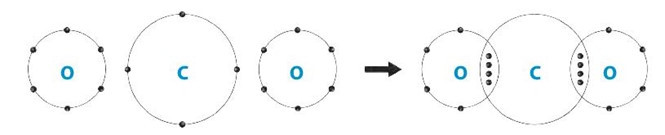
Lời giải:
Nguyên tố T là oxygen.
+ Phân tử đơn chất là khí oxygen (gồm 2 nguyên tử oxygen), khối lượng phân tử là:
16 . 2 = 32 (amu).
+ Phân tử hợp chất có liên kết ion là magnesium oxide (gồm 1 nguyên tử Mg và 1 nguyên tử O), khối lượng phân tử là: 24 + 16 = 40 (amu).
+ Phân tử hợp chất có liên kết cộng hóa trị là carbon dioxide (gồm 1 nguyên tử C và 2 nguyên tử O), khối lượng phân tử là: 12 + 16 . 2 = 44 (amu).

Lời giải:
Các nguyên tố trong phân tử glucose chỉ gồm các nguyên tố phi kim nên trong phân tử glucose chỉ có liên kết cộng hóa trị.
Khối lượng phân tử: 12 . 6 + 1 . 12 + 16 . 6 = 180 (amu).
Lời giải:
(B) là potassium iodide. Trong phân tử (B) có liên kết ion nên (B) là hợp chất ion.
Phân tử (B) gồm 1 nguyên tử K (potassium) và 1 nguyên tử I (iodine).
Khối lượng phân tử (B) là: 39 + 127 = 166 (amu).

Lời giải:
Khối lượng phân tử (D) = khối lượng nguyên tử (M) + x. khối lượng nguyên tử (Cl)
Với x là số nguyên tử Cl.
Thay số vào ta được: 135 = khối lượng nguyên tử (M) + x . 35,5
+ Với x = 1, khối lượng nguyên tử (M) = 99,5 amu (loại)
+ Với x = 2, khối lượng nguyên tử (M) = 64 amu (thỏa mãn).
Vậy M là Cu.
Vì phân tử (D) chứa Cu và Cl nên trong phân tử (D) có liên kết ion.
Xem thêm lời giải sách bài tập Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Bài 7: Hóa trị và công thức hóa học
Bài 9: Đồ thị quãng đường - thời gian
Bài 11: Tốc độ an toàn giao thông
Xem thêm tài liệu Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Chân trời sáng tạo
- Giải sbt Toán 7 – Chân trời sáng tạo
- Lý thuyết Toán 7 – Chân trời sáng tạo
- Soạn văn lớp 7 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Soạn văn lớp 7 (ngắn nhất) – Chân trời sáng tạo
- Văn mẫu lớp 7 – Chân trời sáng tạo
- Giải sgk Lịch sử 7 – Chân trời sáng tạo
- Lý thuyết Lịch Sử 7 – Chân trời sáng tạo
- Giải sbt Lịch sử 7 – Chân trời sáng tạo
- Giải sgk Địa lí 7 – Chân trời sáng tạo
- Lý thuyết Địa Lí 7 – Chân trời sáng tạo
- Giải sbt Địa lí 7 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 7 Friend plus – Chân trời sáng tạo
- Giải sbt Tiếng Anh 7 Friend plus– Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 7 Friends plus đầy đủ nhất
- Bài tập Tiếng Anh 7 Friends plus theo Unit có đáp án
- Giải sgk Giáo dục công dân 7 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 7 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 7 – Chân trời sáng tạo
- Giải sgk Công nghệ 7 – Chân trời sáng tạo
- Lý thuyết Công nghệ 7 – Chân trời sáng tạo
- Giải sbt Công nghệ 7 – Chân trời sáng tạo
- Giải sgk Tin học 7 – Chân trời sáng tạo
- Lý thuyết Tin học 7 – Chân trời sáng tạo
- Giải sbt Tin học 7 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 7 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 7 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 7 – Chân trời sáng tạo
- Giải sgk Âm nhạc 7 – Chân trời sáng tạo
