Sách bài tập Hóa học 10 (Chân trời sáng tạo): Ôn tập chương 4
Với giải sách bài tập Hóa học 10 Ôn tập chương 4 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Ôn tập.
Giải sách bài tập Hóa học lớp 10 Ôn tập chương 4
Trong phản ứng trên chất đóng vai trò chất khử là:
Lời giải:
Đáp án đúng là: B.
Số oxi hóa của C tăng từ +2 lên +4 nên CO đóng vai trò là chất khử.
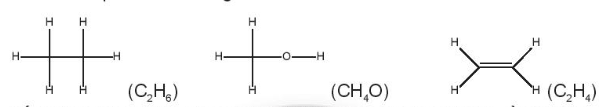
OT4. 2 trang 49 SBT Hóa học 10. Cho các phân tử có công thức cấu tạo sau:
Số oxi hóa trung bình của nguyên tử C trong các phân tử trên lần lượt là:
Lời giải:
Đáp án đúng là: A.
+ C2H6
Số oxi hóa của H là +1; gọi số oxi hóa trung bình của C là x ta có:
2.x + 6.(+1) = 0 ⇒ x = -3.
+ CH4O
Số oxi hóa của H là +1; số oxi hóa của O là -2.
Gọi số oxi hóa trung bình của C là y ta có:
1.y + 4.(+1) + 1.(-2) = 0 ⇒ y = -2.
+ C2H4
Số oxi hóa của H là +1; gọi số oxi hóa trung bình của C là z ta có:
2.z + 4.(+1) = 0 ⇒ x = -2.
OT4.3 trang 49 SBT Hóa học 10. Thực hiện các phản ứng sau:
Số phản ứng chlorine đóng vai trò chất oxi hóa là:
Đáp án đúng là: B.
(a)
⇒ Chlorine vừa là chất oxi hóa – vừa là chất khử.
(b)
⇒ Chlorine vừa là chất oxi hóa – vừa là chất khử.
(c )
⇒ Chlorine là chất oxi hóa.
(d)
⇒ Chlorine là chất oxi hóa.
Lời giải:
Đáp án đúng là: A.
Bromine vừa là chất oxi hóa, vừa là chất khử trong phản ứng:
Lời giải:
Đáp án đúng là: C
Số oxi hóa của sulfur trong các hợp chất: SO2; H2SO4; H2S; Na2SO3 lần lượt là +4; +6; -2; +4.
Trong H2S thì sulfur có số oxi hóa thấp nhất nên nguyên tử sulfur chỉ thể hiện tính khử (trong điều kiện phản ứng phù hợp) trong hợp chất H2S.
OT4.6 trang 49 SBT Hóa học 10. Tính số oxi hóa các nguyên tố có đánh dấu *:
Lời giải:
a)
Giải thích trường hợp:
Ta có trong hợp chất này Na có số oxi hóa +1; O có số oxi hóa -2; gọi số oxi hóa Cr là x:
2.(+1) + x + 4.(-2) = 0 ⇒ x = +6.
Học sinh làm tương tự với các phần còn lại.
b.
Giải thích trường hợp:
Ta có trong ion này, H có số oxi hóa +1, gọi số oxi hóa của N là y.
1.y + 4. (+1) = +1 ⇒ y = -3.
Học sinh làm tương tự với các phần còn lại.
Lời giải:
a)
Br2 là chất oxi hoá do số oxi hoá của Br giảm từ 0 xuống -1 sau phản ứng.
b)
Zn là chất khử do số oxi hoá tăng từ 0 lên +2 sau phản ứng.
c)
K2Cr2O7 là chất oxi hoá do số oxi hoá của Cr giảm từ +6 xuống +3 sau phản ứng.
Lời giải:
- Phản ứng oxi hoá - khử:
;
Phản ứng không phải oxi hoá - khử:
- Ethanol lên men thành acetic acid:
a) Cho biết vai trò của các chất trong các phản ứng (1) và (2).
Lời giải:
a) Vai trò của các chất:
Glucose vừa là chất oxi hoá, vừa là chất khử.
CH3CH2OH (hay C2H6O) là chất khử; O2 là chất oxi hóa.
b)
Theo sơ đồ phản ứng, khối lượng của glucose là: 0,5.180 = 90 gam.
Do hiệu suất của cả quá trình là 50%. Khối lượng glucose cần dùng là:
a) Cân bằng phương trình phản ứng.
Lời giải:
a) Cân bằng phương trình phản ứng:
Phương trình phản ứng:
b) Số mol KMnO4 cần dùng để phản ứng hết với calcium oxalate kết tủa từ 1 mL
máu là: 10-6 mol
Xét sơ đồ:
Khối lượng ion calcium (mg) trong 100 mL máu là:
.
Lời giải:
Số mol oxygen = Số mol ammonium perchlorate =
Số mol aluminium phản ứng với O2:
Khối lượng aluminum phản ứng: 230 tấn
Số mol aluminum oxide sinh ra:
Khối lượng aluminum oxide sinh ra: 434 tấn.
Lời giải:
Gọi Al: x mol và Zn: y mol.
Số mol O2:
Phương trình hóa học xảy ra:
Theo khối lượng ta có: 27x + 65y = 30,3 (1)
Theo số mol O2 ta có:
Từ (1) và (2) giải hệ phương trình được: x = 0,4; y = 0,3;
Khối lượng là 0,2.102 = 20,4 g và khối lượng ZnO là 0,3. 81 = 24,3 g.
a) Cân bằng các phản ứng biết rằng nguyên tử oxygen trong Na2O2, KO2 là nguyên tố tự oxi hóa – khử.
Lời giải:
a) Cân bằng các phản ứng:
-
Phương trình phản ứng:
-
Phương trình phản ứng:
b) Dựa vào phản ứng với khí CO2 cần trộn với KO2 theo tỉ lệ 1 : 2 về số mol thì thể tích khí O2 sinh ra sẽ bằng thể tích của khí CO2 được hấp thụ theo phản ứng sau:
a. Cân bằng 2 phản ứng trên theo phương pháp thăng bằng electron.
b. Trong hai cách trên, cách nào ít làm ô nhiễm môi trường hơn?
Lời giải:
a) Cân bằng 2 phương trình hóa học:
- Phương trình 1:
Phương trình phản ứng:
- Phương trình 2:
Phương trình phản ứng:
b) Cách thứ nhất (cách có phương trình phản ứng 1) ít làm ô nhiễm môi trường hơn do không thải khí SO2 ra môi trường.
a) Viết phản ứng và cân bằng phương trình hóa học theo phương pháp thăng bằng electron.
Lời giải:
a) Viết phản ứng và cân bằng phương trình hóa học:
Phương trình hóa học:
b)
Theo phương trình hóa học ta có:
. Vậy X là kim loại iron (Fe)
Phương trình hoá học:
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo