Sách bài tập Hóa học 10 (Chân trời sáng tạo): Ôn tập chương 6
Với giải sách bài tập Hóa học 10 Ôn tập chương 6 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Ôn tập.
Giải sách bài tập Hóa học lớp 10 Ôn tập chương 6
Lời giải:
Đáp án đúng là: B.
Theo định luật tác dụng khối lượng, tốc độ của phản ứng được viết dưới dạng:
v=k×C2NO×CO2
Nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì:
v'
Vậy nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì tốc độ sẽ giảm 4 lần.
A. 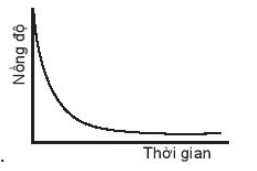
B. 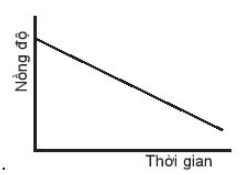
C. 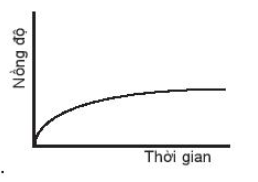
D. 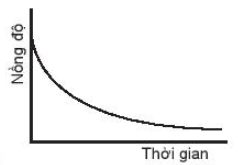
Lời giải:
Đáp án đúng là: A.
Đường cong nồng độ ở đồ thị A dốc nhất nên có tốc độ phản ứng nhanh nhất.
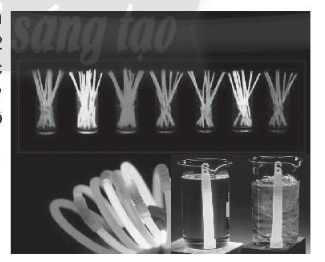
A. nồng độ
B. chất xúc tác
C. bề mặt tiếp xúc
D. nhiệt độ
Lời giải:
Đáp án đúng là: D.
Thanh đặt trong cốc nước nóng phát sáng hơn so với thanh đặt trong cốc nước lạnh.
Vậy yếu tố nhiệt độ đã ảnh hưởng đến tốc độ phản ứng.
Lời giải:
Trong hầu hết các phản ứng hóa học, tốc độ phản ứng tăng khi nhiệt độ tăng. Muốn pha một cốc trà đá có đường, bằng cách thêm đá viên và đường vào cốc trà nóng, thứ tự cho vào cốc trà nóng là đường, đá viên. Vì đường tan tốt hơn trong nước nóng.
OT6.5 trang 74 SBT Hóa học 10. Cho phương trình hóa học của phản ứng:
Lời giải:
Biểu thức tốc độ:, k là hằng số tốc độ phản ứng.
Khi nồng độ mol/L của CO và O2 là 1 M, thì: v = k × 12 × 1= k.
k là tốc độ riêng của phản ứng .
Lời giải:
Tính tốc độ trung bình (mL/s) của phản ứng trong 60 giây
OT6.7 trang 74 SBT Hóa học 10. Trong phản ứng: A → sản phẩm.
a. Tính tốc độ trung bình của phản ứng trong phút thứ nhất và trong phút thứ 2.
b. Nhận xét tốc độ phản ứng trong phút thứ nhất và phút thứ 2. Giải thích.
Lời giải:
a) Tốc độ trung bình của phản ứng trong phút thứ nhất:
Tốc độ trung bình của phản ứng trong phút thứ 2:
b) Tốc độ trung bình của phản ứng trong phút thứ nhất và phút thứ hai không bằng nhau, vì nồng độ chất A giảm theo thời gian, làm giảm số va chạm hiệu quả nên tốc độ phản ứng giảm.
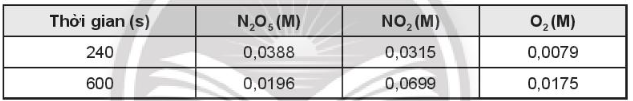
OT6.8 trang 74 SBT Hóa học 10. Xét phản ứng phân hủy N2O5 theo phương trình hóa học:
, xảy ra ở 56oC cho kết quả theo bảng:
Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.
Lời giải:
Tốc độ trung bình của phản ứng được tính trong khoảng thời gian t1 = 240 (s) đến t2 = 600 (s) ⇒ ∆t = 600 – 240 = 360 (s); ∆C = Csau – Cđầu
Tốc độ trung bình của phản ứng
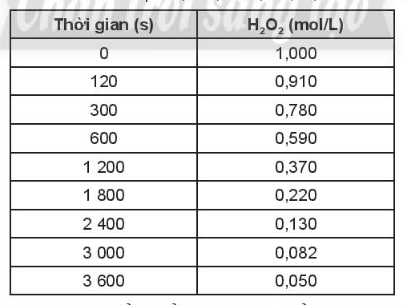
a. Tính tốc độ trung bình của phản ứng phân hủy H2O2 theo thời gian.
b. Tốc độ phản ứng thay đổi thế nào theo thời gian? Giải thích sự thay đổi đó.
Lời giải:
a) Tốc độ phản ứng phân huỷ theo thời gian
|
Thời gian (s) |
H2O2 (mol/L) |
Tốc độ phản ứng (mol/L.s) |
|
0 |
1,000 |
0 |
|
120 |
0,910 |
7,5 × 10-4 |
|
300 |
0,780 |
7,3 × 10-4 |
|
600 |
0,590 |
6,8 × 10-4 |
|
1200 |
0,370 |
5,3 × 10-4 |
|
1800 |
0,220 |
4,3 × 10-4 |
|
2400 |
0,130 |
3,6 × 10-4 |
|
3000 |
0,082 |
3,1 × 10-4 |
|
3600 |
0,050 |
2,6 × 10-4 |
b) Tốc độ phản ứng giảm dần theo thời gian. Tốc độ phản ứng phụ thuộc vào nồng độ chất tham gia, theo thời gian, nồng độ H2O2 giảm dần nên tốc độ phản ứng giảm.
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo