Sách bài tập Hóa học 10 Bài 3 (Chân trời sáng tạo): Nguyên tố hóa học
Với giải sách bài tập Hóa học 10 Bài 3: Nguyên tố hóa học sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 3.
Giải sách bài tập Hóa học lớp 10 Bài 3: Nguyên tố hóa học
Bài 3.1 trang 11 SBT Hóa học 10: Cho các phát biểu sau:
(1) Trong một nguyên tử luôn có số proton bằng số electron và bằng số đơn vị điện tích hạt nhân.
(2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối.
(3) Số khối là khối lượng tuyệt đối của nguyên tử.
(4) Số proton bằng số đơn vị điện tích hạt nhân.
(5) Đồng vị là các nguyên tố có cùng số proton nhưng khác nhau về số neutron.
Lời giải:
Đáp án đúng là: C
Các phát biểu (2); (3); (5) sai.
(2) sai vì tổng số proton và số neutron trong một hạt nhân được gọi là số khối.
(3) sai vì số khối là khối lượng tương đối của nguyên tử, khối lượng tuyệt đối là tổng khối lượng của proton, neutron và electron.
(5) sai vì đồng vị là những nguyên tử có cùng số proton nhưng khác nhau về số neutron.
Bài 3.2 trang 11 SBT Hóa học 10: Cho các phát biểu sau, phát biểu nào đúng về đồng vị?
A. Những phân tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau.
B. Những ion có cùng số hạt proton nhưng khác nhau về số hạt electron là đồng vị của nhau.
C. Những chất có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau.
D. Những nguyên tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau.
Lời giải:
Đáp án đúng là: D
Những nguyên tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau.
(1) Các đồng vị có tính chất hóa học giống nhau.
(2) Các đồng vị có tính chất vật lí khác nhau.
(3) Các đồng vị có cùng số electron ở vỏ nguyên tử.
(4) Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
Lời giải:
Đáp án đúng là: D
Cả 4 phát biểu đều đúng.
Lời giải:
Đáp án đúng là: A
Số khối (A) = 56 + 81 = 137.
Số hiệu nguyên tử (Z) = số electron = 56.
Vậy kí hiệu nguyên tử:
Lời giải:
Đáp án đúng là: B
Có 6 loại phân tử O2 là: 16O – 16O; 16O – 17O; 16O – 18O; 17O – 17O; 17O – 18O; 18O – 18O;
Bài 3.6 trang 12 SBT Hóa học 10: Có 3 nguyên tử: . Những nguyên tử nào là đồng vị của một nguyên tố?
Lời giải:
Đáp án đúng là: C
X và Z có cùng số proton (là 6) nên là đồng vị của một nguyên tố.
Lời giải:
Không có nguyên tử boron nào có khối lượng chính xác là 10,81 amu do 10,81 là nguyên tử khối trung bình của các đồng vị boron trong tự nhiên.
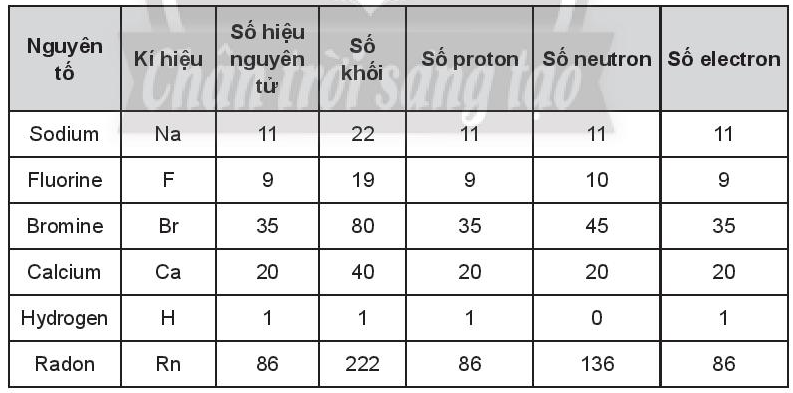
Bài 3.8 trang 12 SBT Hóa học 10: Hoàn thành các thông tin trong bảng sau:
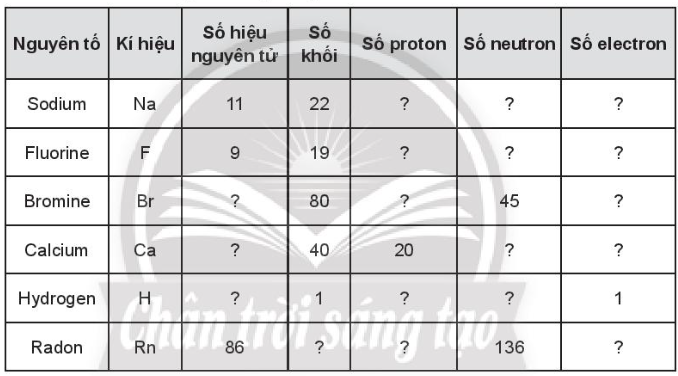
Lời giải:
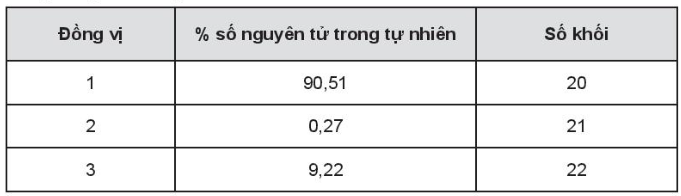
Tính nguyên tử khối trung bình của nguyên tố X.
Lời giải:
Nguyên tử khối trung bình của nguyên tố X:
Bài 3.10 trang 13 SBT Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau:
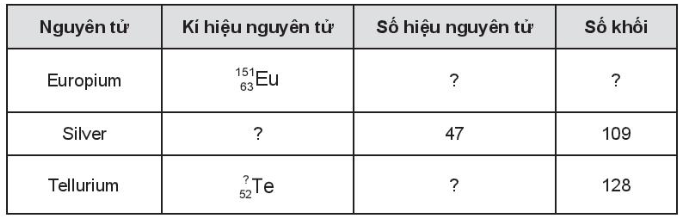
Lời giải:
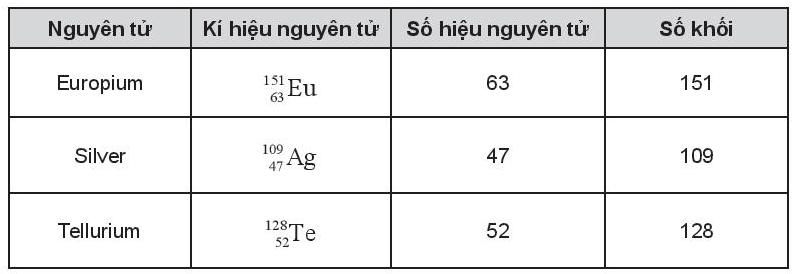
Bài 3.11 trang 13 SBT Hóa học 10: Cho biết số proton, neutron và electron của nguyên tử .
Lời giải:
Số proton = số electron = Z = 30.
Số neutron = số khối (A) – số hiệu nguyên tử (Z) = 65 – 30 = 35.
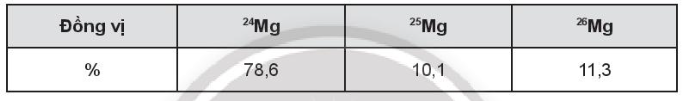
Giả sử trong hỗn hợp nói trên có 50 nguyên tử , số nguyên tử tương ứng của hai đồng vị và lần lượt là:
A. 389 và 56.
B. 56 và 389.
C. 495 và 46.
D. 56 và 495.
Lời giải:
Đáp án đúng là: A
Giả sử trong hỗn hợp nói trên có 50 nguyên tử , số nguyên tử tương ứng của hai đồng vị còn lại là:
+ Số nguyên tử 24Mg: nguyên tử.
+ Số nguyên tử 26Mg: nguyên tử.
Bài 3.13* trang 13 SBT Hóa học 10: Hãy so sánh:
a. Số lượng hợp chất và số lượng nguyên tố.
b. Số lượng nguyên tố và số lượng đồng vị.
Lời giải:
a) Số lượng hợp chất lớn hơn số lượng nguyên tố vì hợp chất là sự kết hợp của 2 hay nhiều nguyên tố.
b) Số lượng nguyên tố ít hơn số lượng đồng vị vì hầu hết các nguyên tố hóa học đều có nhiều đồng vị.
Lời giải:
Trong X có 2 nguyên tử M và 1 nguyên tử O.
Nguyên tử O có pO = 8 và nO = 8
Tổng số hạt cơ bản trong phân tử X có công thức M2O là 140 nên:
4pM + 2nM + 2pO + nO = 140 hay 4pM + 2nM = 116 (1)
Trong phân tử X có tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44 nên:
(4pM + 2pO) – ( 2nM + nO) = 44 hay 4pM – 2nM = 36 (2)
Từ (1) và (2) có pM = 19 và nM = 20.
Vậy M là K (potassium); X là K2O.
Lời giải:
Kí hiệu số đơn vị điện tích hạt nhân X, Y lần lượt là ZX; ZY; số neutron (hạt không mang điện) của X và Y lần lượt là NX và NY.
Mỗi phân tử XY2 có tổng các hạt proton, neutron, electron bằng 178 nên:
2ZX + 4ZY + NX + 2NY = 178 (1)
Trong XY2, số hạt mang điện nhiều hơn số hạt không mang điện là 54 nên:
2ZX + 4ZY – (NX + 2NY) = 54 (2)
Từ (1) và (2) ta có: 2ZX + 4ZY = 116 (3)
Lại có trong XY2 số hạt mang điện của X ít hơn số hạt mang điện của Y là 12, nên:
2ZX + 12 = 4ZY (4)
Từ (3) và (4) ta có: ZX = 26; ZY = 16.
Vậy X là sắt (iron, Fe); Y là lưu huỳnh (sulfur, S).
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo
