Trắc nghiệm Luyện tập tính chất của kim loại (có đáp án)
Trắc nghiệm Bài 22: Luyện tập tính chất của kim loại
-
385 lượt thi
-
31 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Một số kim loại như Fe, Cr, Al thụ động trong HNO3 đặc nguội và H2SO4 đặc nguội.
Câu 2:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Kim loại tồn tại ở trạng thái rắn (trừ Hg). Hg có tonc = – 39oC
Câu 3:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Vonfam (W) có nhiệt độ nóng chảy cao nhất trong các kim loại (3410oC) nên thường được dùng để chế tạo dây tóc bóng đèn
Câu 4:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
2KHCO3 K2CO3 + CO2 + H2O
Câu 5:
18/07/2024Cho các phát biểu sau:
(1) Các oxit của kim loại kiềm phản ứng với CO tạo thành kim loại.
(2) Các kim loại Ag, Fe, Cu và Mg đều được điều chế bằng phương pháp điện phân dung dịch.
(3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Cho Cu vào dung dịch FeCl3 dư, thu được dung dịch chứa 3 muối. Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
Phát biểu đúng là (4)
Câu 6:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
D sai vì Tính dẻo Al < Ag < Au
Câu 7:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Kim loại kiềm có số electron nhường bằng 1
Bảo toàn electron:
1.nM = 2.
→ nM = 2.0,01 = 0,02 mol
MM = = 39 (g/mol) (K)
Câu 8:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Các cặp chất xảy ra phản ứng là: Fe và HCl; Fe và CuSO4; Fe và FeCl3; Cu và FeCl3.
Fe + 2HCl → FeCl2 + H2
Fe + CuSO4 → FeSO4 + Cu
Fe + 2FeCl3 → 3FeCl2
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Câu 9:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Chỉ một số kim loại như Al, Zn,... tác dụng được với bazơ
Câu 10:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Kim loại nào có tính khử yếu nhất sẽ bị đẩy ra trước
Hai kim loại thu được là: Ag và Cu
Hai muối trong dung dịch A là: A1(NO3)3 và Zn(NO3)2
Câu 11:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Chất rắn gồm 3 kim loại: Ag, Cu và Fe
Các quá trình nhận electron có thể xảy ra:
Ag+ +1e → Ag
Cu2+ + 2e → Cu
Các quá trình nhường electron có thể xảy ra:
Al → Al3+ + 3e
Fe → Fe2+ + 2e
Vì Fe dư nên Al đã phản ứng hết, tức là số mol e do Al nhường nhỏ hơn hoặc bằng mol e do Ag+ và Cu2+ có thể nhận.
Vậy: hay (1)
Dấu “=” xảy ra khi Al phản ứng hoàn toàn và vừa đủ, Fe hoàn toàn chưa phản ứng.
Để Fe dư thì tổng số mol e do Al và Fe nhường phải lớn hơn tổng số mol e mà Cu 2+ và Ag+ có thể nhận.
Tức là: 3a + 2b > 2c + d hay (2)
Từ (1) và (2)
→
Câu 12:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án C
nY = 13,44 : 22,4 = 0,6 mol
→ = 0,3 mol;
nNO = 0,2 mol; = 0,1 mol
n e nhận = + 3.n NO + 8.
= 1,7 mol
Trong muối = n e nhận = 1,7 mol
m muối = mKL + Trong muối
= 100 + 1,7. 62 = 205,4 gam
Bảo toàn nguyên tố N:
= n N
= Trong muối + + n NO + 2
→ = 1,7 + 0,3 + 0,2 + 2.0,1
= 2,4 mol
Câu 13:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
= 0,4 mol
Phương trình phản ứng
Fe3O4 + 4H2 3Fe + 4H2O
= .0,4 = 0,1 mol
→ = m = 0,1.232 = 23,2 gam
Câu 14:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Theo đề bài x > hay 2x > n.
Như vậy số mol e do Mg nhường lớn hơn số mol e mà Ag+ có thể nhận. Tức là Ag+ đã phản ứng hết.
→ Sau phản ứng thu được dung dịch chứa 3 ion kim loại là: Mg2+, Zn2+, Cu2+ dư
Số mol e do Mg và Zn nhường phải nhỏ hơn tổng số mol e mà Ag+ và Cu2+ có thể nhận.
Ta có: 2x + 2y < 2m + n hay y < m – x +
Câu 15:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Xét dung dịch X: Có 0,01 mol AgNO3 và 0,1x mol Cu(NO3)2
Xét chất rắn Z: Khối lượng Z lớn hơn khối lượng bạc có thể tạo thành (2,58 > 0,01.108). Vậy trong Z ngoài Ag còn có kim loại khác (Cu hoặc Cu và Fe).
Các quá trình nhường electron:
Fe → Fe2+ + 2e
Các quá trình nhận electron:
Ag+ + 1e → Ag
Cu2+ + 2e → Cu
Trường hợp 1: Z gồm 2 kim loại Ag và Cu, vậy Fe đã phản ứng hết
Gọi số mol Cu2+ đã phản ứng là a.
Bảo toàn e: số mol e do sắt nhường = số mol e do Ag+ và Cu2+ nhận
→ 2. = 0,01 + 2a
→ a = 0,025 mol
Mặt khác, khối lượng Z là:
108.0,01 + 64.0.025 = 2,68 ≠ 2,58.
→ Loại. Trường hợp này không xảy ra.
Trường hợp 2: Z gồm 3 kim loại Ag, Cu và Fe. Như vậy Ag+ và Cu2+ đã phản ứng hết, Fe dư.
Gọi số mol Fe đã phản ứng là b.
Bảo toàn electron:
2.nFe phản ứng = 1.nAg + 2.nCu
→ 2b = 0,01 + 2.0,1x (1)
Mặt khác, khối lượng Z là:
108.0.01 + 64.0,1x + (1,68 - 56b) = 2,58 (2)
Giải phương trình (1) và (2) ta được:
b = 0,0175 và x = 0,125.
Câu 16:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương trình phản ứng:
Mg + 2FeCl3 → MgCl2 + 2FeCl2
Mg + FeCl2 → MgCl2 + Fe
Khối lượng chất rắn thu được nhỏ hơn khối lượng Fe tối đa tọa thành (3,36 < 0,12.56) nên Mg phản ứng hết. Chất rắn chỉ có Fe.
Phương trình phản ứng:
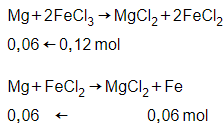
→ nMg = 0,06 + 0,06 = 0,12 mol
→ mMg = m = 0,12.24 = 2,88 gam
Câu 17:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Cu không phản ứng được với HCl
= 2,24: 22,4 = 0,1 mol
Fe + 2HCl → FeCl2 + H2
= nFe = 0,1 mol
→ mFe = 0,1.56 = 5,6g
→ mCu = 12 – mFe = 12 – 5,6 = 6,4g
Câu 18:
21/07/2024Cho các phản ứng sau :
X + HNO3 (đặc, nóng) → A + NO2 + H2O
A + Cu → X + D
X có thể là kim loại nào trong số các kim loại sau ?
 Xem đáp án
Xem đáp án
Đáp án D
Đồng (Cu) đẩy được X ra khỏi muối nên Cu là kim loại có tính khử mạnh hơn X.
→ X là Ag
Câu 19:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương trình phản ứng
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
→ = = 0,15 mol
→ V = 0,15.22,4 = 3,36 lít
Câu 20:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Theo dãy điện hóa của kim loại, thứ tự tăng dần tính oxi hóa của các ion kim loại được sắp xếp như sau:
(5) Na+/Na <(1)Fe2+/Fe< (2) Pb2+/Pb < (3)2H+/H2 < (7)Cu2+/Cu <(6) Fe3+/Fe2+ < (4) Ag+/Ag
Câu 21:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phương trình phản ứng xảy ra:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
Sau phản ứng dung dịch gồm:
Fe(NO3)3 và AgNO3 dư
Câu 22:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Theo dãy điện hóa thứ tự thế điện cực tăng dần là: Mg2+/Mg, Fe2+/Fe, Ni2+/Ni, Cu2+/Cu, Fe3+/Fe2+, Ag+/Ag
Thứ tự các ion bị khử là: Ag+, Fe3+, Cu2+
Ion Mg2+ và Fe2+ không bị khử.
Câu 23:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Thanh thứ nhất giảm và thành thứ 2 tăng nên: 64 < M < 207
Chỉ có Zn (Z = 65) thỏa mãn
Câu 24:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
mO = 11,8 – 8,6 = 3,2g
Oxit + 2HCl Muối + H2O
nO = 0,2 =
Bảo toàn nguyên tố H:
nHCl = 2. = 0,4 mol
→ VHCl = 0,2 lít
Câu 25:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Kim loại có tính dẻo, tính dẫn điện, dẫn nhiệt và có ánh kim. Những tính chất vật lí chung này do các electron tự do gây ra.
Câu 26:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án B
A. Phát biểu đúng vì xảy ra phản ứng
3NaOH + FeCl3 → 3NaCl + Fe(OH)3 nâu đỏ
B. Phát biểu không đúng vì
Fe + 3AgNO3 dư Fe(NO3)3 (màu vàng) + 3Ag.
C. Phát biểu đúng vì xảy ra phản ứng tạo muối Fe2(SO4)3 màu vàng
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
D. Phát biểu đúng vì phản ứng tạo muối Cu(NO3)2 màu xanh
Cu + Fe(NO3)3 → Cu(NO3)2 + Fe(NO3)2
Câu 27:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án C
nFe = nAl = = 0,1 mol
= = 0,05 mol
Sau phản ứng thu được Y gồm 3 kim loại là: Ag, Cu, Fe dư
Chất rắn không tan Z gồm Cu, Ag
Bảo toàn electron cho cả quá trình:
Trong đó Al và Fe hòa tan hết trong dung dịch.
Chất rắn không tan Z gồm Cu, Ag
ne nhường = ne nhận
→ 3.nAl + 2.nFe = nAg + 2.nCu + 2.
→ 3.0,1 + 2.0,1 = nAg + 2nCu + 2.0,05
→ nAg + 2nCu = 0,4 (1)
Lại có mAg + mCu = 28 gam
→ 108.nAg + 64.nCu = 28 (2)
Từ (1) và (2) → nAg = 0,2 mol; nCu = 0,1 mol
= = 1M
Câu 28:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
A. đúng.
B. Sai vì lớp ngoài cùng của kim loại thường có từ 1 đến 3 electron.
C. Sai vì tính chất vật lí chung của kim loại: dẻo, dẫn điện, dẫn nhiệt, ánh kim là do các electron tự do trong kim loại gây ra.
D. Sai vì ở điều kiện thường Hg ở thể lỏng.
Câu 29:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
mO = 8,4 – 6,72 = 1,68g
→ nO = 0,105 mol
6,72g M cần 0,105 mol O
→ 5,04g M cần
= 0,07875 mol O
Nhận thấy Số mol e M nhường ở hai phản ứng với oxi dư và phản ứng với HNO3 là như nhau. Nên số mol e O nhận bằng số mol e NO nhận
→ 2.nO = 3.nNO
→ 2.0,7875 = 3.nNO
→ nNO = 0,0525 mol
→ VNO = 1,176 lít
Câu 30:
23/07/2024Chia hỗn hợp X gồm K, Al, Fe thành hai phần bằng nhau.
- Cho phần 1 vào dung dịch KOH dư thu được 0,784 lít khí H2 (đktc).
- Cho phần 2 vào một lượng dư H2O, thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hòa tan hoàn toàn Y vào dung dịch HCl dư, thu được 0,56 lít khí H2 (đktc).
Khối lượng (tính theo gam) của K, Al, Fe trong mỗi phần hỗn hợp X lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Đặt x = nK, y = nAl, z = nFe trong 1 phần.
Phần 1: cho vào KOH dư thì K và Al đã phản ứng hết.
Bảo toàn eletron: nK + 3nAl = 2
→ x + 3y = 2.0,035 = 0,07 (1)
Phần 2: Cho vào nước dư tạo thành số mol H2 nhỏ hơn số mol H2 ở phần 1
→ Hỗn hợp kim loại Y (Fe và Al còn dư)
Áp dụng định luật bảo toàn nguyên tố
nAl phản ứng = nK = = x
→ nAl dư = y – x
Bảo toàn electron trong phản ứng X + H2O
→ nK + 3.nAl = 2.
→ x + 3x = 2.0,02 → x = 0,01 (2)
Xét phản ứng:
Y + HCl 0,25 mol H2
Bảo toàn electron
3.nAl dư + 2.nFe = 2.
→ 3(y – x) + 2z = 0,25.2 (3)
Từ (1), (2), (3)
Câu 31:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
28g chất rắn gồm MgO và Fe2O3
→ mO trong MgO = 28 – 20 = 8g
→ nMg = nO = 8 : 16 = 0,5 mol
Bảo toàn electron trong đó Mg cho e, NO2 nhận e
→ 2nMg =
→ = 2.0,5 = 1 mol
→ V = 22,4 lít
Có thể bạn quan tâm
- Trắc nghiệm Luyện tập tính chất của kim loại (có đáp án) (384 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại có đáp án (Nhận biết) (216 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại có đáp án (Thông hiểu) (297 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại có đáp án (Vận dụng) (217 lượt thi)
- 14 Câu trắc nghiệm luyện tập tính chất của kim loại có đáp án (194 lượt thi)
Các bài thi hot trong chương
- 80 câu trắc nghiệm Đại cương về kim loại cơ bản (1065 lượt thi)
- 100 câu trắc nghiệm Đại cương về kim loại nâng cao (788 lượt thi)
- Trắc nghiệm Điều chế kim loại (có đáp án) (719 lượt thi)
- Trắc nghiệm Ăn mòn kim loại (có đáp án) (505 lượt thi)
- Trắc nghiệm Tính chất của kim loại, dãy điện hóa kim loại (có đáp án) (352 lượt thi)
- Trắc nghiệm Tính chất của kim loại. Dãy điện hóa của kim loại có đáp án (Thông hiểu) (337 lượt thi)
- Trắc nghiệm Hợp kim (có đáp án) (336 lượt thi)
- Trắc nghiệm Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại (có đáp án) (325 lượt thi)
- Trắc nghiệm Điều chế kim loại có đáp án (Nhận biết) (263 lượt thi)
- Trắc nghiệm Luyện tập điều chế kim loại và sự ăn mòn kim loại (có đáp án) (260 lượt thi)
