Trắc nghiệm Hợp chất của sắt (có đáp án)
Trắc nghiệm Bài 32: Hợp chất của sắt
-
481 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Cặp oxi hóa - khử Fe3+/Fe2+ đứng trước cặp oxi hóa - khử Ag+/Ag trong dãy điện hóa.
→ Theo quy tắc α thì Ag không tác dụng với dung dịch FeCl3
Câu 2:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án C
+ Dung dịch HNO3 (đặc, nóng, dư) là một chất oxi hóa mạnh, khi tác dụng với các hợp chất sắt ở mức oxi hóa trung bình như +2 hoặc +8/3 thì sắt trong các oxit đó sẽ bị oxi hóa lên mức cao nhất là +3, đồng thời nitơ trong axit nitric sẽ bị khử về mức +4 tạo thành NO2.
+ Khi các hợp chất của sắt ở mức oxi hóa +3 tác dụng với axit nitric (đặc, nóng) thì chỉ đơn thuần là phản ứng trao đổi, không phải phản ứng oxi hóa khử nên không tạo chất khí.
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Câu 3:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án C
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Câu 4:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Dung dịch X vừa làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu
→ Trong dung dịch X có Fe2+ và Fe3+.
→ Oxit sắt là Fe3O4.
Phương trình phản ứng:
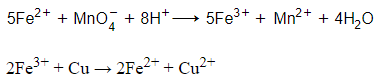
Câu 5:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
FeO, Fe2O3, Fe3O4 FeCl2, FeCl3 Fe2O3
= 3 : 160 = 0,01875 gam
Coi hỗn hợp ban đầu gồm Fe, O.
nFe = 2 = 2.0,01875
= 0,0375 mol
→ nO =
= 0,04375 mol
Bảo toàn nguyên tố O
→ = nO = 0,04375 mol
Bảo toàn nguyên tố H:
nHCl = 2 = 2.0,04375
= 0,0875 mol
→ V = 87,5 ml.
Câu 6:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Dư 1,6g kim loại
→ mCu dư = 1,6g;
dung dịch A gồm: Fe(NO3)2; Cu(NO3)2
→ nCu phản ứng = 3,2 – 1,6 = 1,6 gam
→ = nCu phản ứng = 0,025 mol
→ = 0,025.188 = 4,7 gam
= 0,05 mol
→ = 0,05.180 = 9 gam
→ m muối = 4,7 + 9 = 13,7 gam
Bảo toàn electron
→ = 2nFe + 2nCu phản ứng
= 2. 0,05 + 2. 0,025 = 0,15 mol
→
Câu 7:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Sau phản ứng thu được hỗn hợp gồm 2 kim loại Fe, Cu → H+ và NO3-, Cu2+ hết.
Dung dịch chỉ chứa FeCl2: 0,2 mol (bảo toàn Cl- = 0,4 mol), Cu: 0,05 mol
→ m Fe pư = 0,2 .56 = 11,2 gam
→ 0,8m gam kim loại gồm:
mFe dư = m - 11,2 gam và
mCu = 0,05.64 = 3,2 gam
→ 0,8m = 3,2 + m - 0,2.56
→ m = 40 gam.
Câu 8:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
= nO trong oxit
= 2,24 : 22,4 = 0,1 mol
mFe = m hỗn hợp - mO
→ mFe = 17,6 – 0,1.16
→ mFe = 16 gam
Câu 9:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Khử Fe2O3 bằng CO trong lò cao ở nhiệt độ khoảng 500 - 600oC thu được FeO là sản phẩm chính.
3Fe2O3 + CO 2Fe3O4 + CO2
Fe3O4 + CO 3FeO + CO2
Câu 10:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Lượng sắt phản ứng là tối đa nên sau phản ứng chỉ thu được muối sắt (II)
hết, phản ứng tính theo
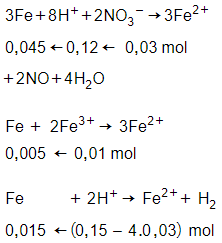
nFe = 0,045 + 0,005 + 0,015
= 0,065 mol
→ mFe = 0,065.56 = 3,64 gam.
Câu 11:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Có thể điều chế Fe(OH)3 bằng cách Cho muối sắt(III) tác dụng dung dịch NaOH dư
FeCl3 + 3NaOH dư → Fe(OH)3 + 3NaCl
Câu 12:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Trong các oxit MgO, Fe2O3, Al2O3 các kim loại đều có số oxi hóa cao nhất nên không bị oxi hóa khi phản ứng với dung dịch HNO3 loãng
Fe trong FeO có số oxi hóa +2 chưa phải là mức oxi hóa cao nhất nên bị oxi hóa bởi dung dịch HNO3 loãng lên mức oxi hóa +3
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Câu 13:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
A. Không dùng Mg vì dư Mg sẽ thu được kim loại sắt
Mg + 2Fe3+ → Mg2+ + 2Fe2+
Mg + Fe2+ → Mg2+ + Fe
B. Dùng lượng dư Cu
Cu + 2Fe3+ → Cu2+ + 2Fe2+
C. Không dùng Ba vì Ba phản ứng với nước trong dung dịch tạo hiđroxit kết tủa với Fe3+
Ba + 2H2O → Ba(OH)2 + H2
3OH- + Fe3+ → Fe(OH)3
D. Ag không khử được Fe3+
Câu 14:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
= 9,75 : 162,5 = 0,06 mol
Quy đổi hỗn hợp A về (Fe và O)
nFe = = 0,06 mol
→ nO = = 0,04 mol
Nếu cho A tác dụng với dung dịch HNO3. Bảo toàn electron ta có:
3nFe = 3nNO + 2nO
→ 3.0,06 = 3.nNO + 2.0,04
→ nNO = 0,033 → VNO = 0,747 lít
Câu 15:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
= 0,4 mol
→ = 0,4.63 = 25,2 gam
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
Phản ứng (1) xảy ra, khối lượng chất tan giảm đi, mà theo đề bài, khối lượng chất tan là 26,44 gam > 25,2 gam nên xảy ra phản ứng hoà tan Fe dư
2Fe3+ + Fe → 3Fe2+ (2)
→ Phản ứng (1) xảy ra hoàn toàn,
nFe(1) =
= = 0,1 mol
→ mFe(1) = 5,6 gam
+ = 26,44
→ = 26,44 – 0,1.242 = 2,24 gam
→ mFe = 5,6 + 2,24 = 7,84 gam
Câu 16:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phương trình phản ứng
3Fe + 4H2O Fe3O4 + 4H2
Câu 17:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
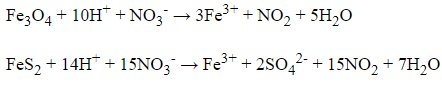
Đặt số mol Fe3O4 và số mol FeS2 lần lượt là a và b mol
→ a + 15b = = 0,07 mol (1)
= 0,061 mol
→ 3a + b = 0,061.2 = 0,122 mol (2)
Từ (1) và (2) có:
a = 0,04 và b = 0,002 mol
(Y) = nNaOH – 3.
= 0,4 – 3.0,122 = 0,034 mol
= 10a + 14b + (Y)
= 10.0,04 + 14.0,002 + 0,034
= 0,462 mol
→ = a =
Câu 18:
22/07/2024Cho sơ đồ phản ứng sau: Fe → muối X1 → muối X2 → muối X3 → Fe
X1, X2, X3 là các muối của sắt (II)
Theo thứ tự X1, X2, X3 lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án C
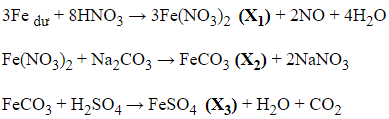
Câu 19:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Dùng dung dịch HNO3 đặc vì Fe2O3 chỉ xảy ra phản ứng trao đổi, nhưng Fe3O4 xảy ra phản ứng oxi hóa khử tạo ra khí không màu hóa nâu trong không khí.
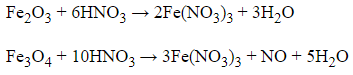
Câu 20:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
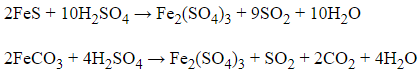
→ Hỗn hợp A gồm SO2 và CO2
Câu 21:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Câu 22:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
nFeO = 3,6 : 72
= 0,05 mol = nO
Bảo toàn nguyên tố:
nH = 2 = 2nO
= 2.0,05 = 0,1mol
nHCl = nH = 0,1 mol
Câu 23:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Giả sử hỗn hợp có x mol Fe và 1 mol FeS
Phản ứng với HCl khí tạo thành là H2 (x mol) và H2S (1 mol)
→ V = (x + 1).22,4 (lít) (1)
Phản ứng với HNO3
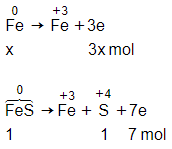
→ Sản phẩm khử có 1 mol SO2 và mol NO
→ 2V = (1 + ).22,4 lít (2)
Từ (1) và (2) có
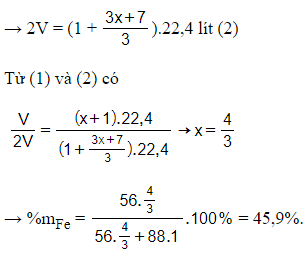
Câu 24:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
nAl = 0,4 mol; = 0,15 mol
Giả sử H = x
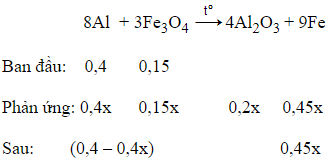
Bảo toàn electron:
3.nAl + 2.nFe = 2.
→ 1,5(0,4 – 0,4x) + 0,45x = 0,48
→ x = 0,8
→ H% = 80%
Câu 25:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
4Fe(OH)2 + O2 2Fe2O3 + 4H2O
Câu 26:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
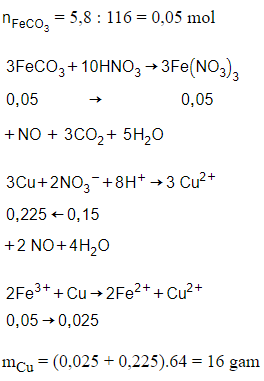
Câu 27:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
x mol CuFeS2 + HNO3 đặc, nóng
→ y mol NO2
Ta có các quá trình nhường, nhận electron:
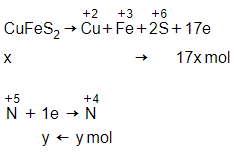
Bảo toàn electron ta có: 17x = y
Câu 28:
18/07/2024Cho sơ đồ phản ứng:
![]()
Hai chất x, y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
Phương trình phản ứng
Fe + 2FeCl3 (x) → 3FeCl2
2Fe + 3Cl2 (y) → 2FeCl3
Câu 29:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
nFeO = 2,16 : 72 = 0,03 mol
Phương trình phản ứng:
![]()
Bảo toàn electron:
nFeO = 3.nNO
→ 0,03 = 3.nNO
→ nNO = 0,01 mol
→ VNO = 0,01.22,4 = 0,224 lít
Câu 30:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phản ứng của oxit + CO thực chất là:
CO + [O]trong chất rắn → CO2
Khối lượng khí tăng chính là khối lượng chất rắn giảm
→ mchất rắn giảm = mO phản ứng = 4,8g
→ nO = 4,8 : 16 = 0,3 mol
→ mFe = mOxit – mO
= 16 – 4,8 = 11,2
→ nFe = 11,2 : 56 = 0,2 mol
→ nFe : nO = 0,2 : 0,3 = 2 : 3
→ Oxit là Fe2O3
Có thể bạn quan tâm
- Trắc nghiệm Hợp chất của sắt (có đáp án) (480 lượt thi)
- 15 Câu trắc nghiệm hợp chất của sắt có đáp án (324 lượt thi)
Các bài thi hot trong chương
- 150 câu trắc nghiệm Crom - Sắt - Đồng nâng cao (1211 lượt thi)
- 150 câu trắc nghiệm Crom - Sắt - Đồng cơ bản (972 lượt thi)
- Trắc nghiệm Hợp kim của sắt (có đáp án) (572 lượt thi)
- Trắc nghiệm Sắt (có đáp án) Hóa học lớp 12 (558 lượt thi)
- Trắc nghiệm Crom và hợp chất của crom (có đáp án) (437 lượt thi)
- Trắc nghiệm Sơ lược về niken, kẽm, chì, thiếc (có đáp án) (402 lượt thi)
- Trắc nghiệm Đồng và hợp chất của đồng (có đáp án) (376 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của sắt và hợp chất của sắt (có đáp án) (354 lượt thi)
- 7 Câu trắc nghiệm luyện tập tính chất hóa học của crom và hợp chất của crom có đáp án (276 lượt thi)
- 15 Câu trắc nghiệm hợp kim của sắt có đáp án (269 lượt thi)
