Trắc nghiệm Sơ lược về niken, kẽm, chì, thiếc (có đáp án)
Trắc nghiệm Bài 36: Sơ lược về niken, kẽm, chì, thiếc
-
402 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron của Zn là:
[Ar]3d104s2
Zn ở ô 30 (z = 30), chu kỳ 4 (4 lớp electron), nhóm IIB (2 electron hóa trị, nguyên tố d).
Câu 2:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Nhận biết khí H2S bằng dung dịch Pb(NO3)2 cho kết tủa màu đen
H2S + Pb(NO3)2 → PbS↓ đen + 2HNO3.
Câu 3:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
ZnO + 2H+ → Zn2+ + H2O
Fe3+ + 3OH- → Fe(OH)3↓
Zn2+ + 2OH- → Zn(OH)2↓
Zn(OH)2↓ + 2OH- → + 2H2O
Sau phản ứng chỉ thu được kết tủa là Fe(OH)3
Câu 4:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
ZnO, Al2O3 có tính lưỡng tính.
Câu 5:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Đồng bạch là hợp kim Cu – Ni (25% Ni).
Câu 6:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Để chống ăn mòn, người ta dùng một kim loại có tính khử lớn hơn Fe, thường là Zn, ghép vào vỏ tàu biển bằng thép để bảo vệ vỏ tàu, như thế Zn sẽ bị ăn mòn điện hóa trước.
Câu 7:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
A. sai, Ni không tác dụng với H2
C. sai, Ni không tác dụng với Fe(NO3)2
D. sai, Ni không tác dụng với NaCl
Câu 8:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Thiếc là kim loại trung bình nên phương pháp điều chế tốt nhất là phương pháp nhiệt luyện.
Câu 9:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
A sai do Sn tan trong dung dịch kiềm đặc
B sai, thiếc là kim loại có tính khử trung bình
D sai, thiếc có số oxi hóa phổ biến là +2 và +4
Câu 10:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án: C
Điện phân ZnSO4
Anot (+): oxi hóa nước:
2H2O → 4H+ + O2 + 4e
Catot (-): khử Zn2+:
Zn2+ + 2e → Zn
Câu 11:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Phần lớn niken được dùng để chế tạo hợp kim, Ni có tác dụng làm tăng độ bền, chống ăn mòn và chịu nhiệt độ cao.
→ Ứng dụng quan trọng nhất của Ni là dùng trong ngành luyện kim
Câu 12:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Do Fe có tính khử lớn hơn Sn, lại có đủ điều kiện để xảy ra ăn mòn điện hóa nên Fe sẽ bị ăn mòn điện hóa.
Câu 13:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án C
ZnO được dùng trong y học, với tác dụng làm thuốc đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,..do ZnO có tính chất làm săn da, sát khuẩn, bảo vệ, làm dịu tổn thương da,..
Câu 14:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án C
CO có thể khử được các oxit của kim loại đứng sau Al trong dãy hoạt động hóa học ở nhiệt độ cao
→ MgO không bị khử, chất rắn còn lại sau phản ứng là Cu, Fe, Zn, MgO.
Câu 15:
18/07/2024Để làm sạch một loại thuỷ ngân có lẫn tạp chất là Zn, Sn, Pb cần khuấy loại thuỷ ngân này trong dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Để làm sạch một loại thủy ngân có lẫn tạp chất Zn, Sn, Pb cần khuấy loại thủy ngân này trong Hg(NO3)2
Zn + Hg(NO3)2 → Zn(NO3)2 + Hg
Sn + Hg(NO3)2 → Sn(NO3)2 + Hg
Pb + Hg(NO3)2 → Pb(NO3)2 + Hg
Câu 16:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
nkhí = 0,15 mol
→ nHCl phản ứng = 2.nkhí = 0,3 mol
nHCl dư = 0,2.1,6 – 0,3 = 0,02 mol
→ CM (HCl dư) = 0,02 : 0,2 = 0,1M
→ pH = 1.
Câu 17:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Sn có tính khử lớn hơn Pb nên chỉ có Sn bị ăn mòn điện hóa.
Câu 18:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Gọi nZn = a mol; nFe = b mol
Zn + CuSO4 → ZnSO4 + Cu
Fe + CuSO4 → FeSO4 + Cu
→ nCu = nZn + nFe = a + b mol
Vì khối lượng chất rắn trước và sau phản ứng bằng nhau nên mZn + mFe = mCu
Do đó 65a + 56b = 64(a + b)
→ a = 8b
Vậy phần trăm khối lượng của Zn trong hỗn hợp ban đầu là
%mZn =
== 90,27%
Câu 19:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Số oxi hóa phổ biến của Ni trong hợp chất là +2.
Câu 20:
22/07/2024Cho các phản ứng sau:
Sn + O2
Sn + HNO3 loãng →
Sn + NaOH đặc →
Sn + H2SO4 đặc →
Số phản ứng luôn tạo ra sản phẩm chứa Sn ở số oxi hóa +4 là
 Xem đáp án
Xem đáp án
Đáp án B
Khi Sn tác dụng với O2 ở nhiệt độ cao và H2SO4 đặc thì tạo ra sản phẩm chứa Sn ở số oxi hóa +4
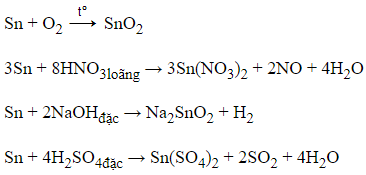
Câu 21:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
= nKOH = 0,2.2 = 0,4 mol
= = 0,3.1 = 0,3 mol
2KOH + ZnCl2 → Zn(OH)2↓ + 2KCl (1)
Theo (1) → ZnCl2 dư.
→ = 0,2 mol
→ m↓= a = 0,2.99 = 19,8 g
Câu 23:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Ta có dãy điện hóa
→ Tính khử của các kim loại theo chiều tăng dần là Au < Ag < Pb < Sn < Ni < Fe < Zn.
Câu 24:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
= nNaOH = 0,25.1 = 0,25 mol
= = 0,1.1 = 0,1 mol
Phương trình hóa học:
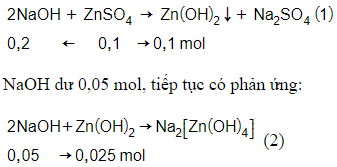
Sau phản ứng (1) và (2):
n↓ = 0,1 – 0,025 = 0,075 mol
→ m↓ = b = 0,075.99 = 7,425 g
Câu 25:
23/07/2024Hòa tan hoàn toàn hỗn hợp gồm Zn và ZnO bằng dung dịch HNO3 dư. Kết thúc thí nghiệm không có khí thoát ra, dung dịch thu được chứa 8g NH4NO3 và 113,4g Zn(NO3)2. Phần trăm số mol của Zn trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Đáp án A
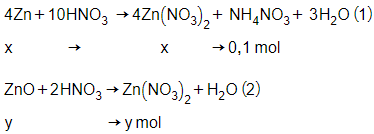
Theo (1) có
nZn = x = 4.0,1 = 0,4 mol
= x + y = 0,6 mol
→ y = nZnO = 0,2 mol
%nZn = = 66,67%
Câu 26:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
FeCl2 + 2NaOH → Fe(OH)2+ 2NaCl
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
Zn(OH)2 + 2NaOH dư → Na2ZnO2 + 2H2O
Kết tủa thu được là Fe(OH)2. Đem nung trong khống khí:
4Fe(OH)2 + O2 2Fe2O3 + 4H2O
Chất rắn thu được là Fe2O3
Câu 27:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
= nNaOH = 2V mol
= = 0,5. 0,2 = 0,1 mol
= 4,95 : 99 = 0,05 mol
2NaOH + ZnCl2 → Zn(OH)2↓ + 2NaCl (1)
2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (2)
Ta có: = 0,05 <
→ Có 2 trường hợp xảy ra
Trường hợp 1: NaOH hết; ZnCl2 dư
Theo (1) → = 2
→ 2V = 0,1 mol
→ V = 0,1 : 2 = 0,05 lít
Trường hợp 2: NaOH và ZnCl2 đều hết và kết tủa tan một phần.
Theo (1) và (2)
→ = 4 – 2.
= 4.0,1 – 2.0,05 = 0,3 mol
→ 2V = 0,3
→ V = 0,3 : 2 = 0,15 lít
Vậy thể tích dung dịch NaOH 2M cần dùng là 0,05 lít hoặc 0,15 lít.
Câu 28:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
= 3,36 : 22,4 = 0,15 mol
Cu không phản ứng với dung dịch KOH loãng nóng
Bảo toàn electron:
2.nZn = 2.
→ nZn = 0,15 mol
→ nCu = 0,25 – 0,15 = 0,1 mol
%mCu =
= 39,63%
Câu 29:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Zn + 2NaOH → Na2ZnO2 + H2
ZnO + 2NaOH → Na2ZnO2 + H2O
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Câu 30:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
AlCl3 + 3NH3 + 3H2O → Al(OH)3+3NH4Cl
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2+2NH4Cl
Zn(OH)2 + 4NH3 dư → [Zn(NH3)4](OH)2
Kết tủa X là Al(OH)3. Nung X:
2Al(OH)3 Al2O3 + 3H2O
Chất rắn Y là Al2O3. Cho luồng hiđro đi qua Y nung nóng, hiđro không khử được Al2O3 nên chất rắn thu được vẫn là Al2O3.
Có thể bạn quan tâm
- Trắc nghiệm Sơ lược về niken, kẽm, chì, thiếc (có đáp án) (401 lượt thi)
- Trắc nghiệm Hóa 12 Bài 36 (có đáp án): Sơ lược về niken, kẽm, chì, thiếc (189 lượt thi)
Các bài thi hot trong chương
- 150 câu trắc nghiệm Crom - Sắt - Đồng nâng cao (1211 lượt thi)
- 150 câu trắc nghiệm Crom - Sắt - Đồng cơ bản (972 lượt thi)
- Trắc nghiệm Hợp kim của sắt (có đáp án) (572 lượt thi)
- Trắc nghiệm Sắt (có đáp án) Hóa học lớp 12 (558 lượt thi)
- Trắc nghiệm Hợp chất của sắt (có đáp án) (480 lượt thi)
- Trắc nghiệm Crom và hợp chất của crom (có đáp án) (436 lượt thi)
- Trắc nghiệm Đồng và hợp chất của đồng (có đáp án) (376 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của sắt và hợp chất của sắt (có đáp án) (353 lượt thi)
- 15 Câu trắc nghiệm hợp chất của sắt có đáp án (324 lượt thi)
- 7 Câu trắc nghiệm luyện tập tính chất hóa học của crom và hợp chất của crom có đáp án (276 lượt thi)
