Trắc nghiệm Đồng và hợp chất của đồng (có đáp án)
Trắc nghiệm Bài 35: Đồng và hợp chất của đồng
-
436 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
17/07/2024Cho các tính chất sau:
(a) là kim loại có màu đỏ.
(b) là kim loại nhẹ.
(c) nóng chảy ở nhiệt độ cao.
(d) tương đối cứng.
(e) dễ kéo dài và dát mỏng.
(g) dẫn điện tốt.
(h) dẫn nhiệt kém.
Có bao nhiêu tính chất vật lí là tính chất vật lí của kim loại đồng?
 Xem đáp án
Xem đáp án
Đáp án B
Tính chất vật lí của kim loại đồng:
- Là kim loại màu đỏ, dẻo, dễ kéo sợi và dát mỏng (có thể dát mỏng đến 0,0025 mm, mỏng hơn giấy viết 5 - 6 lần).
- Có độ dẫn điện và dẫn nhiệt rất cao (chỉ kém bạc).
- Khối lượng riêng lớn 8,98 g/cm3.
- Nhiệt độ nóng chảy cao 1083oC.
→ Có 4 tính chất vật lí là tính chất vật lí của đồng: (a), (c), (e), (g)
Câu 2:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Xảy ra phản ứng:
![]()
Dung dịch Cu2+ có màu xanh; khí NO không màu nhưng hóa nâu trong không khí.
Câu 3:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron của Cu là:
1s22s22p63s23p63d104s1
Vậy Cu ở ô 29 (Z = 29), chu kỳ 4 (do có 4 lớp electron), nhóm IB (1 electron hóa trị, nguyên tố d).
Câu 4:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Trong các hợp chất, đồng có số oxi hóa phổ biến là +1 và +2.
Câu 5:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Đồng thau là hợp kim Cu – Zn (45% Zn).
Câu 6:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
nCu = 3,2 : 64 = 0,05 mol
nH+= 0,8.0,1 + 2.0,2.0,1
= 0,12 mol
nNO3−= 0,8.0,1 = 0,08 mol
![]()
→ Sau phản ứng H+ hết đầu tiên
→ nNO = 2.nH+8
= 2.0,128 = 0,03 mol
→ VNO = 0,03.22,4 = 0,672 lít.
Câu 7:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Đồng có cấu hình electron là [Ar]3d104s1
→ Cấu hình electron của Cu+ và Cu2+ lần lượt là:
[Ar]3d10; [Ar]3d9.
Câu 8:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
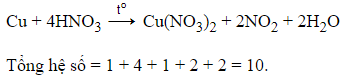
Câu 9:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
![]()
= nAg = 0,1.0,2 = 0,02 mol
= nFe phản ứng (1)
mtăng (1) = 0,02.108 – 0,01.56
= 1,6 gam
Theo bài ra
mKL tăng = 101,72 – 100 = 1,72 gam.
Tiếp tục có phản ứng:
Đặt số mol Fe phản ứng (2) là a mol
Fe (a) + Cu2+ → Fe2+ (a mol) + Cu (2)
mtăng (2) = 64a – 56a
= 1,72 – 1,6
→ a = 0,015 mol
→ mFe = (0,01 + 0,015).56
= 1,4 gam.
Câu 11:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Amoni nitrat NH4NO3
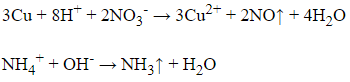
Câu 12:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Giả sử có 1 mol Cu tham gia phản ứng
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
nAg = 2nCu = 2 mol
→ Khối lượng thanh đồng tăng = 2.108 - 64 = 152 gam.
Câu 13:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
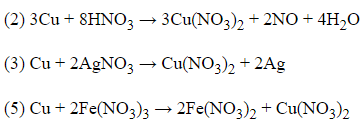
Câu 14:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Thêm lượng dư Fe.
Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu
Kết thúc phản ứng, lọc bỏ kim loại thu được dung dịch FeSO4 tinh khiết,
Câu 15:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Gọi số mol của Fe và Cu trong hỗn hợp lần lượt là x và y mol
→ mhh = 3,04
→ 56x + 64y = 3,04. (1)
Áp dụng định luật bảo toàn electron ta có:
3.nFe + 2.nCu = 3.nNO
→ 3x + 2y = 0,12 (2)
Giải hệ phương trình (1) và (2) được x = 0,02 và y = 0,03
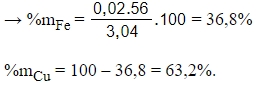
Câu 16:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Chất lỏng Boocđo gồm những hạt rất nhỏ muối đồng(II) sunfat, bazơ không tan và canxi sunfat.
![]()
Để thử nhanh thuốc diệt nấm này tức là phát hiện đồng(II) sunfat dư, người ta dùng đinh sắt: sắt tan ra, có kim loại Cu đỏ xuất hiện.
Fe + CuSO4 → FeSO4 + Cu↓
Câu 17:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Gọi số mol Al và Cu trong m gam hỗn hợp X lần lượt là a và b mol
Trường hợp 1: Cho X vào HCl dư, chỉ có Al phản ứng
2Al + 6HCl → 2AlCl3 + 3H2 (0,15 mol)
→ nAl = 23nH2 = 23.0,15
= 0,1 mol
Trường hợp 2: Cho X vào HNO3 đặc, nguội Al bị thụ động, chỉ có Cu phản ứng
![]()
→ nCu = 12nNO2=12.0,3
= 0,15 mol
→ m = mAl + mCu
= 0,1.27 + 0,15.64 = 12,3 gam.
Câu 18:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Gọi phần trăm số nguyên tử của 2 đồng vị 63Cu và 65Cu lần lượt là x và y (%)
→ x + y = 100 (1)
Nguyên tử khối trung bình của đồng là 63,54
→ 63x+65y100 = 63,54 (2)
Từ (1) và (2) ta được x = 73 và y = 27.
Câu 19:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Kim loại Cu chỉ phản ứng với dung dịch AgNO3
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Câu 20:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
nCuSO4= 0,25.0,15
= 0,0375 mol
→ nCuSO4.5H2O = nCuSO4
=0,0375 mol
→ mCuSO4.5H2O = 0,0375.250
= 9,375 gam
Câu 21:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
4,3265<nFe,Zn<4,3256
→ 0,0664 < nFe, Zn < 0,077
Ta thấy chỉ có Zn và Fe phản ứng hết với CuSO4 mà nFe, Zn < nCuSO4 nên Zn và Fe phản ứng hết.
→ CuSO4 dư → Kết tủa chỉ có Cu
Câu 22:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
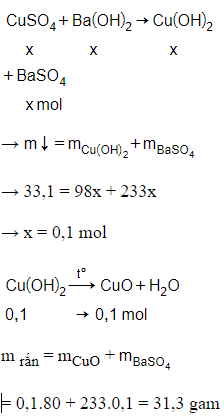
Câu 23:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
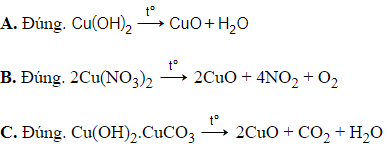
→ Cả cách A, B, C đều đúng.
Câu 24:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Khối lượng kim loại tăng 0,8 gam
→ khối lượng muối trong dung dịch giảm 0,8 gam
→ mmuối = 3,23 – 0,8 = 2,43 gam.
Câu 25:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Theo bài ra có nZn = 0,1 mol;
nCu = 0,2 mol; nFe3+ = 0,4 mol
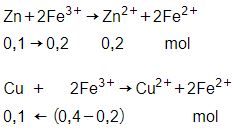
→ nCu dư = 0,2 – 0,1 = 0,1 mol
→ mCu = 0,1.64 = 6,4 gam
Câu 26:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
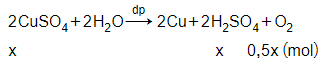
Gọi số mol Cu sinh ra là x mol
→ số mol O2 là 0,5x mol
→ mgiảm = mCu + mO2
→ 8 = 64x + 32.0,5x
→ x = 0,1 mol
→ Dung dịch Y chứa H2SO4: 0,1 mol và CuSO4 dư y mol
Khi cho 0,3 mol Fe vào dung dịch Y thu được dung dịch chứa FeSO4: 0,1 + y (mol)
→ Hỗn hợp kim loại gồm Fe dư:
0,3 – (0,1 + y) mol và Cu: y mol
→ 56 [0,3 – (0,1 + y)] + 64y = 12,4
→ y = 0,15 mol
→ Tổng số mol CuSO4 = x + y = 0,25 mol
→ x = 1,25.
Câu 27:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Cation có tính oxi hóa mạnh nhất sẽ bị khử trước
Sắp xếp theo thứ tự giảm dần tính oxi hóa:
Fe3+ > Cu2+ > Fe2+ > Zn2+
Na+ không bị điện phân.
→ Kim loại cuối cùng thoát ra là Zn
Câu 28:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Kim loại nào có tính khử yếu nhất sẽ bị đẩy ra trước.
→ Chất rắn Y gồm: Ag, Cu, Fe (dư).
Câu 29:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Bảo toàn electron ta thấy:
2.nCl2 = 2(nFe + nCu) = 2a
→ Fe chỉ bị oxi hóa thành Fe(II)
→ Chất rắn Y gồm: FeCl2 và CuCl2
Câu 30:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Hàm lượng Sn có trong hợp kim này là:
%mSn = 119.1
= 27,1%
Có thể bạn quan tâm
- Trắc nghiệm Đồng và hợp chất của đồng (có đáp án) (435 lượt thi)
- Trắc nghiệm Hóa 12 Bài 35 (có đáp án): Đồng và hợp chất của đồng (226 lượt thi)
Các bài thi hot trong chương
- 150 câu trắc nghiệm Crom - Sắt - Đồng nâng cao (1378 lượt thi)
- 150 câu trắc nghiệm Crom - Sắt - Đồng cơ bản (1103 lượt thi)
- Trắc nghiệm Hợp kim của sắt (có đáp án) (631 lượt thi)
- Trắc nghiệm Sắt (có đáp án) Hóa học lớp 12 (601 lượt thi)
- Trắc nghiệm Hợp chất của sắt (có đáp án) (516 lượt thi)
- Trắc nghiệm Crom và hợp chất của crom (có đáp án) (471 lượt thi)
- Trắc nghiệm Sơ lược về niken, kẽm, chì, thiếc (có đáp án) (439 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của sắt và hợp chất của sắt (có đáp án) (391 lượt thi)
- 15 Câu trắc nghiệm hợp chất của sắt có đáp án (359 lượt thi)
- 7 Câu trắc nghiệm luyện tập tính chất hóa học của crom và hợp chất của crom có đáp án (321 lượt thi)
