Đề thi Học kì 2 Hóa học 10 cực hay có đáp án
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 2)
-
3352 lượt thi
-
12 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
15/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tính oxi hóa của các halogen giảm dần theo thứ tự: F2>Cl2>Br2>I2.
Câu 2:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số oxi hóa của Clo trong các chất KClO4, HCl, NaClO lần lượt là: +7; -1; +1.
Câu 3:
03/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dãy chất đều phản ứng với dung dịch axit H2SO4loãng: NaOH, CuO, Mg.
2NaOH + H2SO4→ Na2SO4+ 2H2O
CuO + H2SO4→ CuSO4+ H2O
Mg + H2SO4→ MgSO4+ H2
Câu 4:
11/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Nhỏ AgNO3vào các dung dịch HCl, HI, Na2SO4:
+ Xuất hiện kết tủa trắng thì đó là: HCl, Na2SO4
AgNO3+ HCl → AgCl↓ + HNO3
2AgNO3+ Na2SO4 → 2NaNO3+ Ag2SO4↓
+ Xuất hiện kết tủa vàng đậm là HI
AgNO3+ HI → AgI↓ + HNO3
- Cho BaCl2vào các dung dịch còn lại là HCl và Na2SO4:
+ Xuất hiện kết tủa thì đó là Na2SO4
BaCl2+ Na2SO4→ BaSO4↓ + 2NaCl
+ Không hiện tượng là HCl
Câu 5:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong phòng thí nghiệm không dùng lọ thủy tinh để đựng axit HF.
Vì HF là axit yếu nhưng có tính chất đặc biệt là ăn mòn các đồ vật bằng thủy tinh.
SiO2+ 4HF → SiF4+ 2H2O
Câu 6:
03/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol HCl là: nHCl= 0,04 mol suy ra mHCl= 0,04.36,5 = 1,46 gam
Có:  = 0,02 mol
= 0,02 mol
Suy ra 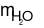 = 0,02.18 = 0,36 gam
= 0,02.18 = 0,36 gam
Áp dụng định luật bảo toàn khối lượng ta có: 2,81 + 1,46 = mmuối+ 0,36
Suy ra mmuối= 2,81 + 1,46 – 0,36 = 3,91 gam
Câu 7:
08/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số mol NaOH là: nNaOH= 0,2.0,2 = 0,04 mol
Do SO2dư nên muối thu được là: NaHSO3
Phương trình phản ứng:
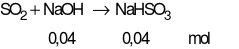
Theo phương trình phản ứng ta có:  = 0,04 mol
= 0,04 mol
Vậykhối lượng muối thu được là:  = 0,04.104 = 4,16g.
= 0,04.104 = 4,16g.
Câu 8:
19/07/2024A.3,36.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol KClO3là:  mol
mol
Phương trình phản ứng:
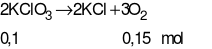
Vậy thể tích khí O2thu được là:
 = 0,15.22,4 = 3,36 lít.
= 0,15.22,4 = 3,36 lít.
Câu 9:
22/07/2024C.14.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
KClO3+ 6HCl → 3Cl2+ KCl + 3H2O
Tổng hệ số các chất trong phản ứng sau khi cân bằng là:
1 + 6 + 3 + 1 + 3 = 14
Câu 10:
05/07/2024 2NH3khi giảm áp suất cân bằng sẽ:
2NH3khi giảm áp suất cân bằng sẽ: Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cho phản ứng: 3H2+ N2 2NH3khi giảm áp suất cân bằng sẽ:
2NH3khi giảm áp suất cân bằng sẽ:
Chuyển dịch từ phải sang trái (chuyển dịch về phía tạo ra nhiều khí hơn)
PHẦN II. TỰ LUẬN (5 Điểm)
Câu 11:
23/07/2024(2,5 điểm).
Viết các phương trình phản ứng hóa học xảy ra theo sơ đồ sau (ghi rõ điều kiện):FeS2  SO2
SO2 SO3
SO3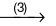 H2SO4
H2SO4  CuSO4
CuSO4 BaSO4
BaSO4
 Xem đáp án
Xem đáp án
Hướng dẫn giải
(1) 4FeS2+ 11O2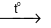 2Fe2O3+ 8SO2
2Fe2O3+ 8SO2
(2) 2SO2+ O2 2SO3
2SO3
(3) SO3+ H2O → H2SO4
(4) H2SO4+ CuO → CuSO4+ H2O
(5) CuSO4+ BaCl2→ BaSO4↓ + CuCl2
Câu 12:
17/07/2024(2,5 điểm).
Cho 3,84 gam hỗn hợp A gồm Mg và FeO tác dụng với dung dịch HCl 0,25M thu được 2,24 lit khí ở đktc.
a, Tính phần trăm khối lượng mỗi chất trong hỗn hợp A.
b, Tính thể tích dung dịch axit HCl đã dùng.
c, Mặt khác, cho hỗn hợp A tác dụng với dung dịch H2SO4đặc nóng dư, thu được V lit hỗn hợp khí Y gồm SO2và H2S (ở đktc). Biết tỉ khối của Y so với H2bằng 26. Tính giá trị của V
 Xem đáp án
Xem đáp án
Hướng dẫn giải
a, Phương trình phản ứng:
Mg + 2HCl → MgCl2+ H2
FeO + 2HCl → FeCl2+ H2O
Số mol khí H2thu được là:  = 0,1 mol
= 0,1 mol

Theo phương trình phản ứng ta có: nMg= 0,1 mol suy mMg= 0,1.24 = 2,4 gam.
Vậy %mMg= 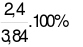 = 62,5%
= 62,5%
%mFeO= 100% - 62,5% = 37,5%
b, Khối lượng của FeO là: mFeO= 3,84 – 2,4 = 1,44 gam
⇒ nFeO= 0,02 mol
Phương trình phản ứng:
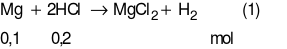
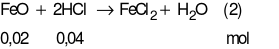
Từ phương trình phản ứng (1) và (2) suy ra nHCl= 0,2 + 0,04 = 0,24 mol
Vậy thể tích dung dịch axit HCl đã dùng là: VHCl=  = 0,96 lít
= 0,96 lít
c,
Tỉ khối của Y so với H2bằng 26 suy ra  = 52, ta có:
= 52, ta có:
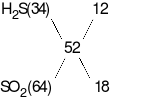
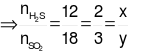
Mặt khác, bảo toàn mol electron ta có: 8x + 2y = 2nMg + nFeO= 0,22
Suy ra x = 0,02 mol; y = 0,03 mol
Vậy V = 22,4.(0,02+0,03) = 1,12 lit
(Họcsinhkhôngđượcsửdụngbảnghệthốngtuầnhoàncácnguyêntốhóahọc)
Bài thi liên quan
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 1)
-
30 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 3)
-
20 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 3)
-
10 câu hỏi
-
30 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 4)
-
10 câu hỏi
-
30 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 5)
-
14 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 5)
-
12 câu hỏi
-
30 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 6)
-
30 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 7)
-
30 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 8)
-
28 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 9)
-
27 câu hỏi
-
40 phút
-
Có thể bạn quan tâm
- Đề thi Học kì 2 Hóa 10 cực hay có đáp án (866 lượt thi)
- Đề thi giữa kì 2 Hóa 10 cực hay có đáp án (410 lượt thi)
- Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (3351 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 1) (623 lượt thi)
- Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận (704 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 1) (908 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 2) (1302 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 2) (720 lượt thi)
- Đề thi Hóa 10 Học kì 2 (Bài kiểm tra học kì) (688 lượt thi)
Các bài thi hot trong chương
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1) (2643 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 1) (790 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2) (755 lượt thi)
- Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 2 - Đề 1) (643 lượt thi)
- Đề thi Hóa 10 Học kì 1 (581 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (535 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 biên soạn (486 lượt thi)
- Đề thi Học kì 1 Hóa 10 có đáp án (344 lượt thi)
- Đề thi giữa kì 1 Hóa 10 cực hay có đáp án (Bài kiểm tra số 2) (315 lượt thi)
