Đề thi Học kì 2 Hóa học 10 cực hay có đáp án
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 11)
-
3356 lượt thi
-
30 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Dãy các axit HX từ HF đến HI thì tính khử và tính axit tăng dần.
Câu 2:
12/07/2024(a) Các halogen đều có số oxi hóa dương
(b) Halogen đứng trước thì đẩy được halogen đứng sau ra khỏi dung dịch muối.
(c) Các halogen đều tan được trong nước.
(d) Các halogen đều tác dụng được với hidro.
Số mệnh đề phát biểu sailà.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- (a) sai vì halogen flo chỉ có số oxi hóa âm là -1.
- (b) sai vì F2không đẩy được halogen đứng sau ra khỏi dung dịch muối.
- ( c) sai vì I2gần như không tan trong nước.
- (d) đúng
Câu 3:
07/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Trong phòng thí nghiệm, người ta điều chế H2S bằng phản ứng hoá học của dung dịch axit clohiđric với sắt (II) sunfua.
FeS + 2HCl → FeCl2+ H2S↑
Câu 4:
09/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Trong phòng thí nghiệm, SO2được điều chế bằng cách đun nóng dung dịch H2SO4với muối Na2SO3.
Na2SO3+ H2SO4→ Na2SO4+ H2O + SO2↑
Câu 5:
02/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
HBr + NaOH → NaBr + H2O
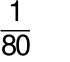
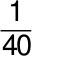
⇒NaOH dư, HBr phản ứng hết ⇒ dung dịch làm quỳ chuyển sang màu xanh.
Câu 6:
15/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- H2SO4tan vô hạn trong nước và toả nhiều nhiệt. Nếu rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm.
- Vì vậy, muốn pha loãng dung dịch H2SO4đặc trong phòng thí nghiệm an toàn, người ta rót từ từ axit vào nước và khuấy nhẹ bằng đũa thuỷ tinh mà không làm ngược lại.
Câu 7:
04/07/2024(1) 2KI + O3+ H2O → I2+ 2KOH + O2
(2) 5nH2O + 6nCO2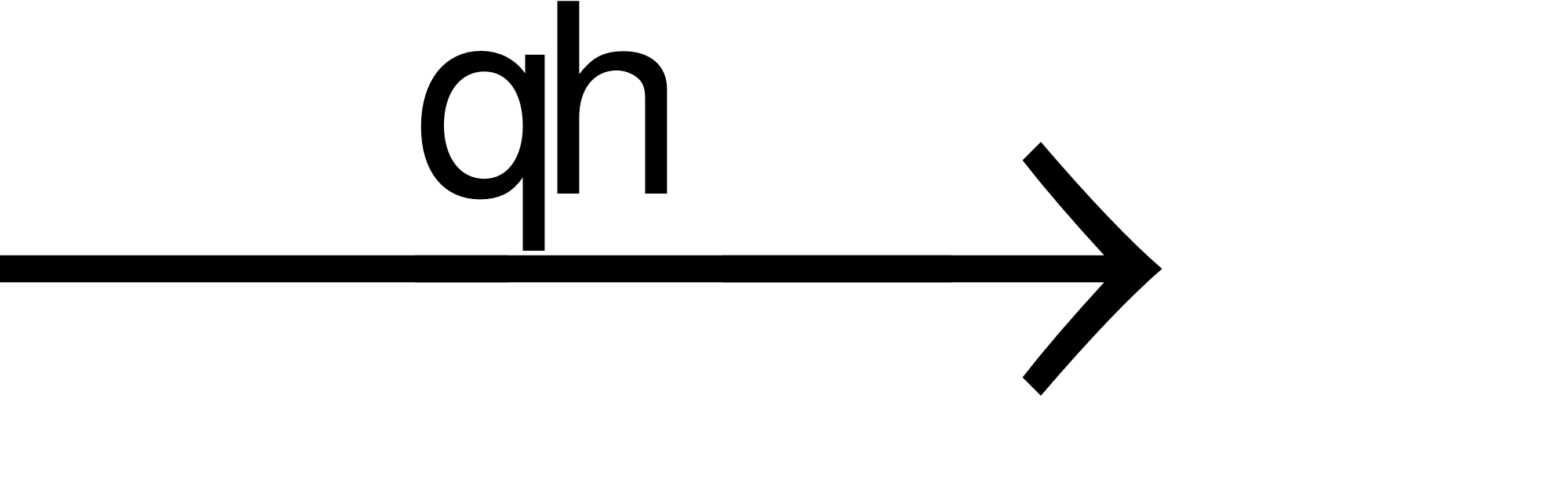 (C6H10O5)n+ 6nO2
(C6H10O5)n+ 6nO2
(3) 2H2O 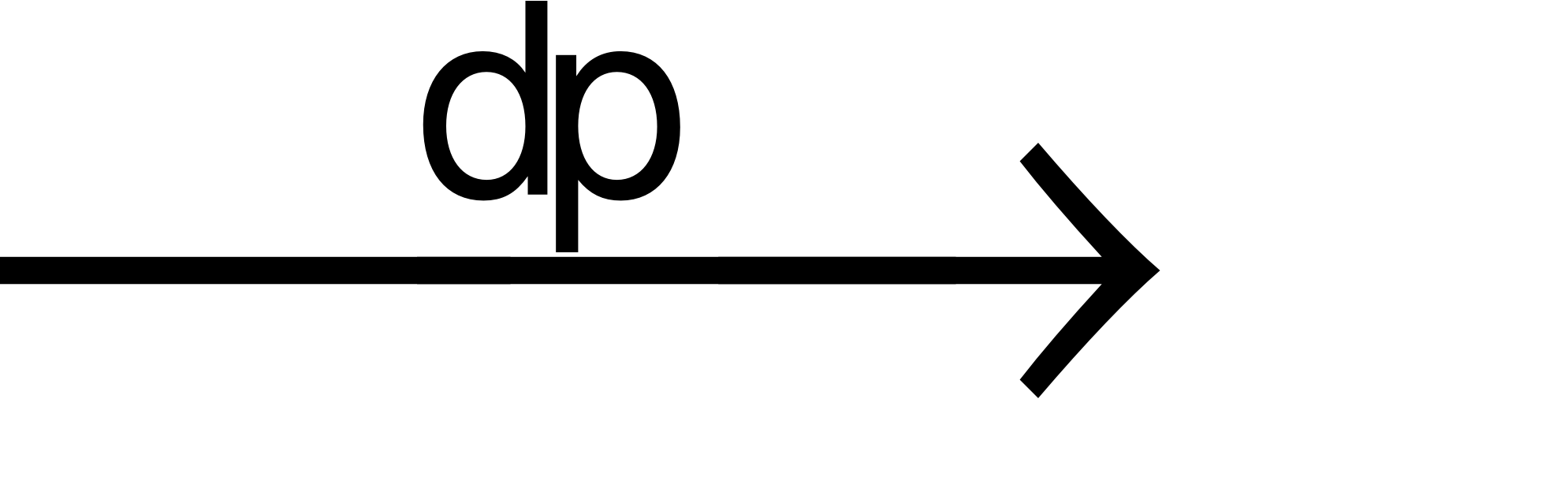 2H2+ O2
2H2+ O2
(4) 2KMnO4→ K2MnO4+ MnO2+ O2
Số phương trình dùng để điều chế oxi trong phòng thí nghiệm là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Trong phòng thí nghiệm, khí oxi được điều chế bằng cách phân huỷ hợp chất giàu oxi và ít bền đối với nhiệt như KMnO4 (rắn), KClO3(rắn),…
2KMnO4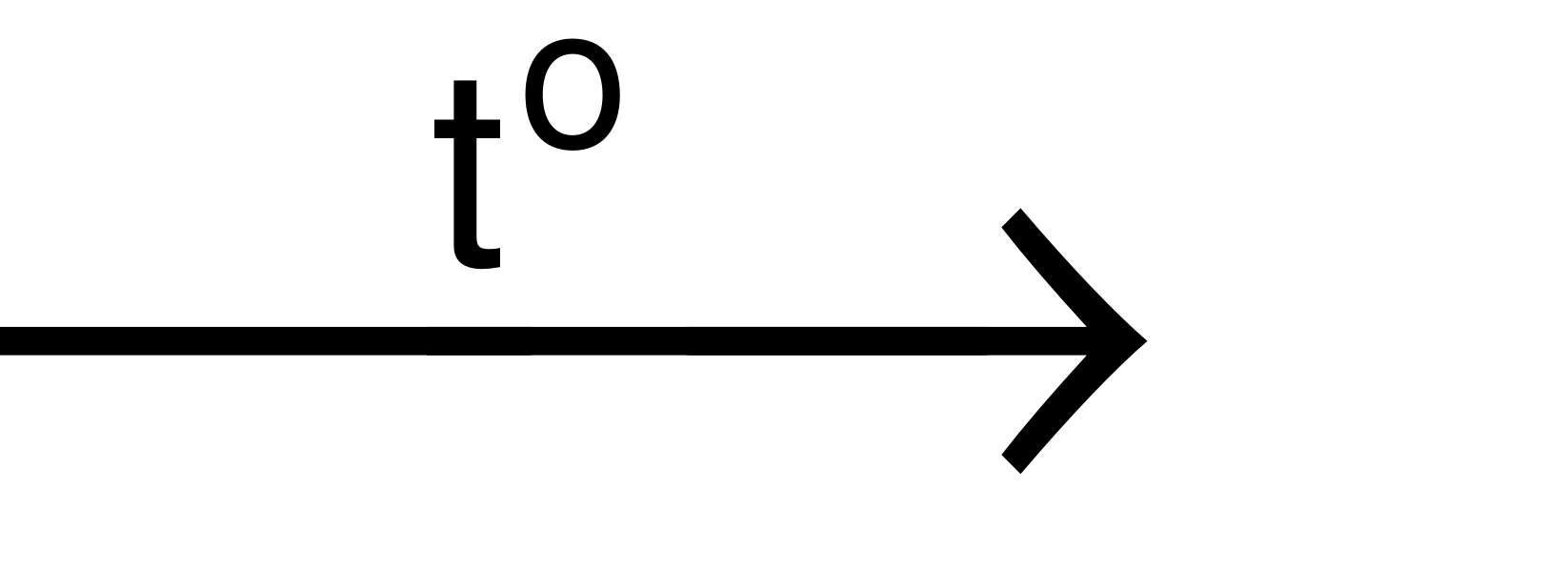 K2MnO4+ MnO2+ O2↑
K2MnO4+ MnO2+ O2↑
Câu 8:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Trong công nghiệp axit sunfuric được điều chế theo sơ đồ: S →SO2→ SO3→ H2SO4.
+ Sản xuất SO2:
S + O2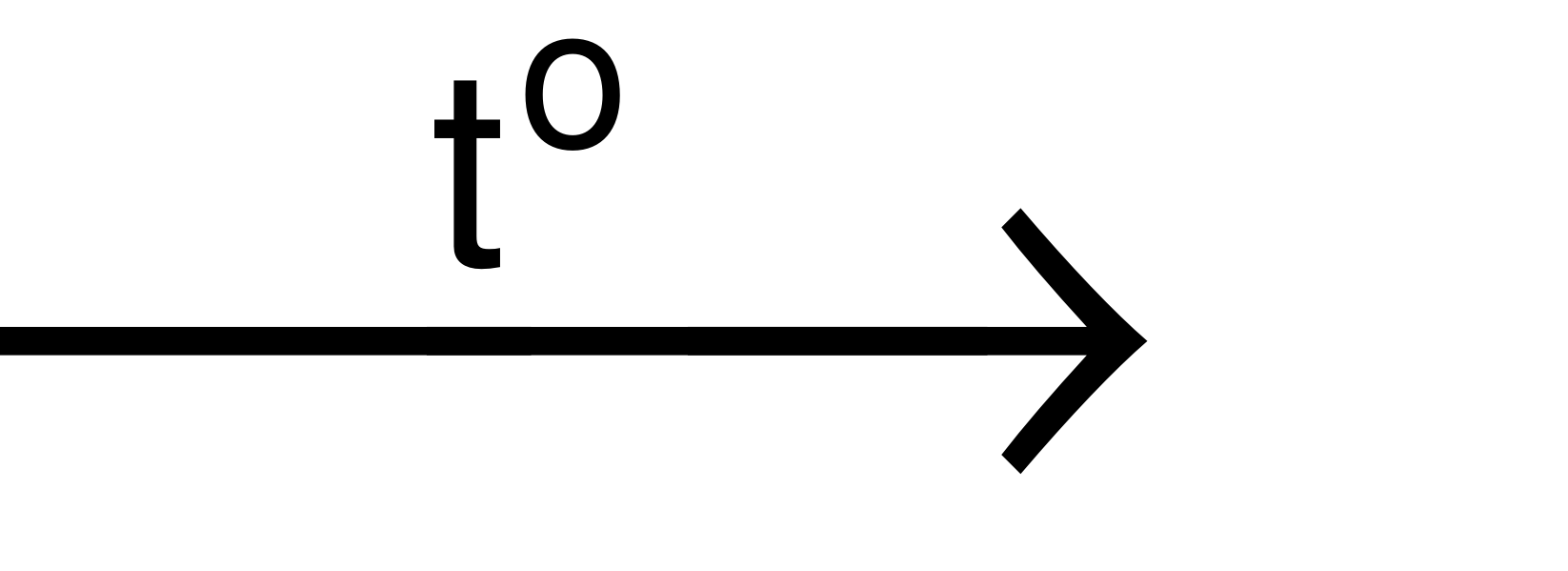 SO2 ( Đốt cháy lưu huỳnh)
SO2 ( Đốt cháy lưu huỳnh)
+ Sản xuất SO3:
2SO2+ O2 2SO3
2SO3
+ Hấp thụ SO3bằng H2SO4.
- Dùng H2SO498% hấp thụ SO3, được oleum H2SO4.nSO3:
H2SO4 + nSO3→ H2SO4.nSO3
- Sau đó pha loãng oleum, được H2SO4đặc.
H2SO4.nSO3+ nH2O → (n + 1) H2SO4
Câu 9:
10/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Trong phòng thí nghiệm, khí Clo được điều chế bằng cách oxi hóa HCl, cho HCl tác dụng với các chất oxi hóa mạnh như KClO3, KMnO4, MnO2,…
- Như vậy theo các đáp án, KMnO4bị khử.
Câu 10:
13/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- HF (axit flohiđric) là axit yếu nhưng có tính chất đặc biệt là ăn mòn các đồ vật bằng thuỷ tinh. Vì vậy, axit HF không thể chứa trong bình thủy tinh.
4HF + SiO2 SiF4+ 2H2O
Câu 11:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Thả giấy quỳ vào dung dịch NaOH, quỳ chuyển xanh. Khi sục clo vào dung dịch, quỳ bắt đầu mất màu dần đến khi mất hẳn. Do Cl2tác dụng với NaOH tạo ra NaClO có tính oxi hoá mạnh, có thể phá hủy các hợp chất màu.
Cl2+ 2NaOH →NaCl + NaClO + H2O
Câu 12:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh, các nguyên tử này rất hoạt động vì chúng dễ thu thêm 1 electron.
Câu 13:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Để nhận biết dung dịch chứa muối clorua ta dùng dung dịch AgNO3.
- Hiện tượng: Xuất hiện kết tủa trắng của AgCl.
Câu 14:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Cho dung dịch NaOH tác dụng lần lượt với các mẫu thử nhận ra:
+ Dung dịch NH4Cl: Có khí mùi khai thoát ra
NaOH + NH4Cl → NaCl + NH3↑ + H2O
+ Dung dịch FeCl3: có kết tủa nâu đỏ
3NaOH + FeCl3→ Fe(OH)3↓(nâu đỏ) + 3NaCl
+ Dung dịch MgBr2: có kết tủa màu tắng
2NaOH + MgBr2→ Mg(OH)2↓(trắng) + 2NaBr
+ Dung dịch CuBr2: có kết tủa xanh
2NaOH + CuBr2→ Cu(OH)2↓( xanh) + 2NaBr
Câu 15:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- H2SO4loãng không tác dụng với kim loại đứng sau H trong dãy hoạt động hoá học.
Loại A, B, D do Ag; Cu; Au; Pt đứng sau H trong dãy hoạt động hóa học.
Câu 16:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Trong y tế, I2 được hòa tan trong etanol để dùng làm chất sát trùng vết thương.
Câu 17:
14/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Đáp án A sai vì AgF là muối tan trong nước.
- Đáp án B sai vì khi hidro halogenua tác dụng với nước tạo thành axit mới có tính chất này.
- Đáp án C sai vì HF là axit yếu.
Câu 18:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
HCl >H2CO3 >H2S.
Câu 19:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- H2SO4có đầy đủ tính chất của axit mạnh. Ngoài ra H2SO4đặc có tính oxi hoá mạnh và tính háo nước.
Câu 20:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Khí Flo dễ dàng tác dụng với nước ngay ở nhiệt độ thường.
- Clo tan 1 phần trong nước.
- Brom tác dụng rất chậm với nước.
- Iot hầu như không tác dụng với nước.
Câu 21:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Theo định nghĩa: Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Câu 22:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Nguyên tử nguyên tố nhóm halogen có 7 electron lớp ngoài cùng: ns2np5.
Câu 23:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Clorua vôi là chất bột màu trắng, xốp. Có công thức phân tử là CaOCl2
Câu 24:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ở điều kiện thường:
- Brom là chất lỏng có màu đỏ nâu.
- Clo là chất khí có màu vàng lục.
- Flo là chất khí có màu lục nhạt.
- Iot là chất rắn dạng tinh thể có màu đen.
Câu 25:
15/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Đán án A loại vì Cu không tác dụng với HCl.
- Đáp án C loại vì Ag không tác dụng với HCl.
- Đáp án D loại vì: Fe + 2HCl → FeCl2 + H2↑, 2Fe + 3Cl2→ 2FeCl3
- Chọn B vì Zn khi tác dụng với HCl và khí clo đều cho muối ZnCl2.
Câu 26:
07/07/2024Số phân tử H2SO4 bị khử và số phân tử H2SO4tham gia tạo muối trong phương trình phản ứng trên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
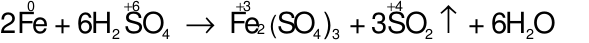
Các quá trình nhường, nhận electron:
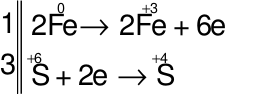
⇒ Số phân tử H2SO4bị khử = 3
⇒ Số phân tử H2SO4 tham gia vào phản ứng = 6
⇒ Số phân tử H2SO4 tạo muối = 6 – 3 = 3
Câu 27:
22/07/2024HCl + KMnO4→ MnCl2+ Cl2+ KCl + H2O
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
16HCl + 2KMnO4→ 2KCl + 5Cl2+ 2MnCl2+ 8H2O.
Tổng hệ số: 16 + 2 + 2 + 5 + 2 + 8 = 35.
Câu 28:
04/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Các kim loại thụ động với H2SO4đặc nguội là: Al, Fe.
II. Phần tự luận (3 điểm)
Câu 29:
15/07/2024(1 điểm)
Hoàn thành chuỗi phản ứng sau (ghi rõ các điều kiện nếu có)NaCl  HCl
HCl  Cl2
Cl2 H2SO4
H2SO4 SO2
SO2
 Xem đáp án
Xem đáp án
Hướng dẫn giải
(1) 2NaCl + H2SO4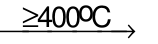 Na2SO4+ 2HCl↑
Na2SO4+ 2HCl↑
(2) 16HCl + 2KMnO4→ 2KCl + 5Cl2↑ + 2MnCl2+ 8H2O
(3) 4Cl2+ 4H2O + H2S → H2SO4+ 8HCl
(4) Na2SO3+ H2SO4→ Na2SO4+ H2O + SO2↑
Câu 30:
02/07/2024(2 điểm)
Hòa tan hoàn toàn 12 gam hỗn hợp X gồm Cu và Fe bằng dung dịch H2SO4đặc nóng thu được 5,6 lít khí SO2(sản phẩm khử duy nhất, ở đktc). Tính %m mỗi kim loại trong hỗn hợp X ban đầu. Xem đáp án
Xem đáp án
Hướng dẫn giải
Gọi 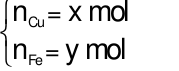
Theo bài ra ta có phương trình: mhh =64x + 56y = 12 gam (1)
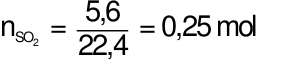
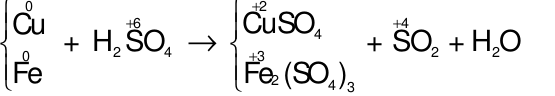
Áp dụng định luật bảo toàn electron ta có: 2x + 3y = 0,25.2 (2)
Từ (1) và (2) ta có hệ phương trình:
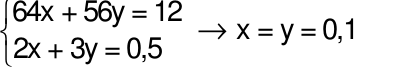
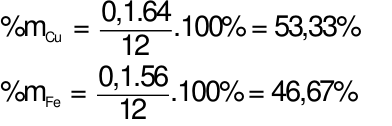
Bài thi liên quan
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 1)
-
30 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 2)
-
12 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 3)
-
20 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 3)
-
10 câu hỏi
-
30 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 4)
-
10 câu hỏi
-
30 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 5)
-
14 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 5)
-
12 câu hỏi
-
30 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 6)
-
30 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 7)
-
30 câu hỏi
-
40 phút
-
-
Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 8)
-
28 câu hỏi
-
40 phút
-
Có thể bạn quan tâm
- Đề thi Học kì 2 Hóa 10 cực hay có đáp án (866 lượt thi)
- Đề thi giữa kì 2 Hóa 10 cực hay có đáp án (410 lượt thi)
- Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (3355 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 1) (623 lượt thi)
- Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận (704 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 1) (909 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 2) (1303 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 2) (720 lượt thi)
- Đề thi Hóa 10 Học kì 2 (Bài kiểm tra học kì) (688 lượt thi)
Các bài thi hot trong chương
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1) (2645 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 1) (790 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2) (755 lượt thi)
- Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 2 - Đề 1) (643 lượt thi)
- Đề thi Hóa 10 Học kì 1 (581 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (535 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 biên soạn (487 lượt thi)
- Đề thi Học kì 1 Hóa 10 có đáp án (344 lượt thi)
- Đề thi giữa kì 1 Hóa 10 cực hay có đáp án (Bài kiểm tra số 2) (316 lượt thi)
