100 câu trắc nghiệm Nito - Photpho cơ bản
100 câu trắc nghiệm Nito - Photpho cơ bản (Đề 4)
-
1184 lượt thi
-
20 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
22/07/2024Có 4 dung dịch trong 4 lọ mất nhãn: amoni sunfat, amoni clorua, natri sunfat, natri hiđroxit. Nếu chỉ được phép dùng một thuốc thử để nhận biết 4 chất lỏng trên ta có thể dùng thuốc thử nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Khi cho dung dịch Ba(OH)2 vào 4 dung dịch:
- Nếu xuất hiện kết tủa trắng và có khí mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
- Nếu xuất hiện kết tủa trắng thì đó là Na2SO4
Na2SO4+ Ba(OH)2→ BaSO4↓ + 2 NaOH
- Nếu xuất hiện khí có mùi khai thì đó là NH4Cl
2NH4Cl+ Ba(OH)2→ BaCl2+ 2NH3↑ + 2H2O
- Còn lại không hiện tượng là NaOH
Câu 2:
20/07/2024Đun nóng hỗn hợp rắn gồm 2 muối (NH4)2CO3 và NH4HCO3 thu được 13,44 lít khí NH3 và 11,2 lít khí CO2 (đktc). Thành phần % của NH4HCO3 là:
 Xem đáp án
Xem đáp án
Đáp án B
Đặt n(NH4)2CO3= xmol; nNh4HCO3= y mol
(NH4)2CO32NH3+ CO2+ 2H2O
x 2x x mol
NH4HCO3NH3+ CO2+ H2O
y y y mol
Ta có nNH3= 2x+y= 13,44/22,4= 0,6
nCO2= x+y= 11,2/22,4= 0,5
Suy ra x=0,1, y=0,4
→ mchất rắn= 0,1.96+ 0,4.79=41,2 gam
→% của NH4HCO3 là: 0,4.79.100%/41,2=76,7%
Câu 3:
17/07/2024Hòa tan hỗn hợp gồm 8,49 gam P và S vào lượng HNO3 vừa đủ thu được dung dịch X và sản phẩm khử duy nhất là NO2. Để trung hòa hoàn toàn X thì cần vừa đủ 0,69 mol NaOH. Số mol NO2 thu được là:
 Xem đáp án
Xem đáp án
Đáp án A
Đặt số mol P và S lần lượt là x, y mol
→ 31x+ 32y= 8,49 (1)
P+ 5HNO3→ H3PO4+ 5NO2+ H2O (1)
S+ 6HNO3→ H2SO4+ 6NO2+ 2H2O (2)
Dung dịch X chứa H3PO4 và H2SO4
H3PO4+ 3NaOH→ Na3PO4+ 3H2O(3)
H2SO4+ 2NaOH→ Na2SO4+ 2H2O (4)
Theeo PT (1) , (2), (3), (4)
Tổng số mol NaOH pứ ở (3), (4) là:
nNaOH= 3nH3PO4+ 2nH2SO4= 3.nP+ 2.nS= 3x+2y=0,69 (2)
Giải hệ gồm (1) và (2) có x=0,15; y= 0,12
Theo PTHH (1) và (2) : nNO2= 5nP+ 6nS= 5x+ 6y= 1,47 mol
Câu 4:
17/07/2024Có 4 lọ chứa 4 dung dịch riêng biệt sau: 1. NH3; 2. FeSO4; 3. BaCl2; 4. HNO3. Các cặp dung dịch nào có thể phản ứng với nhau:
 Xem đáp án
Xem đáp án
Đáp án A
Các phương trình hóa học xảy ra là:
1 và 4: NH3+ HNO3→ NH4NO3
2 và 3: FeSO4+ BaCl2 → BaSO4+ FeCl2
2 và 4: 3Fe2++ 4H++ NO3-→ 3Fe3++ NO + 2H2O
1 và 2: 2NH3+ FeSO4+ 2H2O→ Fe(OH)2+ (NH4)2SO4
Câu 5:
20/07/2024Có 6 dung dịch đựng trong 6 lọ: NH4Cl; (NH4)2SO4; MgCl2; AlCl3; FeCl2; FeCl3. Chỉ dùng một hóa chất nào sau đây có thể giúp nhận biết chúng?
 Xem đáp án
Xem đáp án
Đáp án C
Khi cho Ba vào các dung dịch trên thì:
Ba+ H2O →Ba(OH)2+ H2
Lấy dung dịch Ba(OH)2thu được ở trên cho vào 6 dung dịch:
- Nếu xuất hiện kết tủa trắng và có khí mùi khai thì đó là (NH4)2SO4
(NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
- Nếu xuất hiện khí có mùi khai thì đó là NH4Cl
2NH4Cl+ Ba(OH)2→ BaCl2+ 2NH3↑ + 2H2O
- Nếu xuất hiện kết tủa trắng, không tan trong kiềm dư thì đó là MgCl2
Ba(OH)2+ MgCl2 → Mg(OH)2↓ + BaCl2
-Nếu xuất hiện kết tủa trắng, tan trong kiềm dư thì đó là AlCl3
3Ba(OH)2+ 2AlCl3 → 2Al(OH)3↓ + 3BaCl2
Ba(OH)2+ 2Al(OH)3 → Ba(AlO2)2+4 H2O
- Nếu xuất hiện kết tủa trắng xanh, không tan trong kiềm dư thì đó là FeCl2
Ba(OH)2+ FeCl2 → Fe(OH)2↓ + BaCl2
- Nếu xuất hiện kết tủa nâu đỏ, không tan trong kiềm dư thì đó là FeCl3
3Ba(OH)2+ 2FeCl3 → 2Fe(OH)3↓ + 3BaCl2
Câu 6:
20/07/2024Cho 1,32 gam (NH4)2SO4 tác dụng với lượng dư dung dịch NaOH dư, đun nóng thu được một sản phẩm khí. Hấp thụ toàn bộ lượng khí trên vào dung dịch chứa 3,92 gam H3PO4. Muối thu được là:
 Xem đáp án
Xem đáp án
Đáp án C
(NH4)2SO4+ 2NaOH→ Na2SO4 + 2NH3↑ + 2H2O (1)
Theo PT (1): nNH3= 2. n(NH4)2SO4= 2.0,01=0,02 mol
Có: nH3PO4=0,04mol → T= nNH3/nH3PO4= 2
→ Xảy ra PT sau:
2NH3+ H3PO4→ (NH4)2HPO4
Câu 7:
17/07/2024Cho 6,16 lít khí NH3 và V ml dung dịch H3PO4 0,1M phản ứng hết với nhau được dung dịch X. X phản ứng được tối đa 300 ml dung dịch NaOH 1M. Khối lượng muối khan có trong X bằng:
 Xem đáp án
Xem đáp án
Đáp án C.
n(NH3) = 6,16/22,4 = 0,275mol
n(NaOH) = 1.0,3 = 0,3mol
Dung dịch X phản ứng tối đa với NaOH nên muối thu được là muối Na3PO4
Theo ĐL bảo toàn nguyên tố:
n(H3PO4) = n(Na3PO4) = n(NaOH) / 3 = 0,3/3 = 0,1mol
n(NH3) / n(H3PO4) = 0,275 / 0,1 = 2,75
2 < n(NH3) / n(H3PO4)< 3 → cả 2 chất đều tham gia pư hết
Theo ĐL bảo toàn khối lượng, khối lượng muối thu được là:
m(muối) = m(NH3) + m(H3PO4) = 17.0,275 + 98.0,1 = 14,475g
Câu 8:
18/07/2024Có những nhận định sau về muối amoni:
1) Tất cả muối amoni đều tan trong nước
2) Các muối amoni đều là chất điện li mạnh, trong nước muối amoni điện li hoàn toàn tạo ra ion NH4+ không màu, tạo môi trường bazơ
3) Muối amoni đều phản ứng với dung dịch kiềm giải phóng khí amoniac
4) Muối amoni kém bền đối với nhiệt
Nhóm gồm các nhận định đúng là:
 Xem đáp án
Xem đáp án
Đáp án B
1) Đúng
2) Sai vì NH4+ tạo môi trường axit
3) Đúng
4) Đúng
Câu 9:
23/07/2024Dãy các muối amoni nào khi bị nhiệt phân tạo thành khí NH3?
 Xem đáp án
Xem đáp án
Đáp án A
- ở đáp án A:
(NH4)2CO32NH3+ CO2+ 2H2O
NH4HCO3NH3+ CO2+ H2O
NH4Cl NH3+ HCl
- ở đáp án B:
NH4NO3N2O+ 2H2O (không tạo khí NH3)
- ở đáp án C:
NH4NO2N2+ 2H2O (không tạo khí NH3)
- ở đáp án D:
NH4NO3N2O+ 2H2O (không tạo khí NH3)
Câu 10:
22/07/2024Cho sơ đồ phản ứng sau:
Khí Xdung dịch X Y X Z T
Công thức của X, Y, Z, T tương ứng là:
 Xem đáp án
Xem đáp án
Đáp án C
Khí NH3+ H2O → dung dịch NH3
2NH3+ H2SO4→ (NH4)2SO4 (Y)
(NH4)2SO4+ 2NaOH→ Na2SO4+ 2NH3 (X)+ H2O
NH3+ HNO3→ NH4NO3 (Z)
NH4NO3N2O (T)+ 2H2O
Câu 11:
17/07/2024Tính số mol P2O5 cần thêm vào dung dịch chứa 0,03 mol KOH để sau phản ứng thu được dung dịch chứa hai muối K2HPO4 và KH2PO4 với số mol bằng nhau:
 Xem đáp án
Xem đáp án
Đáp án A
Ta có P2O5+ 3H2O→2H3PO4 (1)
H3PO4+ KOH→ KH2PO4+ H2O (2)
H3PO4+ 2KOH→ K2HPO4+2H2O (3)
Đặt số mol K2HPO4 và KH2PO4 đều là x mol
Theo PT (2), (3):
nKOH= nKH2PO4+ 2nK2HPO4 = x + 2x = 3x = 0,03
Suy ra x= 0,01 mol
→ nH3PO4=nKH2PO4+ nK2HPO4= x+ x= 0,02 mol
→nP2O5= ½. nH3PO4= 0,01 mol
Câu 12:
23/07/2024Cho sơ đồ:
X Y Z T X
Các chất X, T (đều chứa nguyên tố C trong phân tử) có thể lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án A
CO2 (X) + 2NH3 ![]() (NH2)2CO (Y) + H2O
(NH2)2CO (Y) + H2O
(NH2)2CO +2 H2O → (NH4)2CO3 (Z)
(NH4)2CO3 NH4HCO3 (T)+ NH3
NH4HCO3 NH3+ CO2+ H2O
Vậy X là CO2 và T là NH4HCO3
Câu 13:
19/07/2024Muối X là hợp chất chứa nguyên tố N. X có các phản ứng sau:
X+ NaOHY + Z+ A
X T+A
X không thể là chất nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án C
- ở đáp án A:
NH4NO3 (X)+ NaOH →NaNO3(Y)+ NH3 (Z)+ H2O (A)
NH4NO3N2O (T)+ 2H2O (A)
- ở đáp án B:
NH4Cl (X)+ NaOH →NaCl(Y)+ NH3 (A)+ H2O (Z)
NH4Cl NH3 (A)+ HCl (T)
- ở đáp án C:
NH4HCO3 (X)+ 2NaOH →Na2CO3(Y)+ NH3 (A)+ 2H2O (Z)
NH4HCO3NH3 (A)+ CO2+ H2O
PT thứ 2 tạo ra 3 sản phẩm trong khi đề chỉ cho tạo ra 2 sản phẩm
→ X không thể là NH4HCO3
- ở đáp án D:
(NH4)2HPO4(X)+ 3NaOH →Na3PO4(Y)+ 2NH3 (A)+ 3H2O (Z)
(NH4)2HPO42NH3 (A)+ H3PO4 (T)
Câu 14:
21/07/2024Cho sơ đồ:
Trong sơ đồ X, Y lần lượt là các chất:
 Xem đáp án
Xem đáp án
Đáp án C
(NH4)2SO4+ BaCl2 (X) → BaSO4↓+ 2NH4Cl
NH4Cl+ AgNO3 (Y)→ AgCl↓ + NH4NO3
Đáp án A loại vì CaSO4 ít tan
Đáp án B,D loại vì HCl không phản ứng với (NH4)2SO4
Câu 15:
17/07/2024Khi so sánh NH3 và NH4+, phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án B
Trong NH3 nitơ có cộng hóa trị 3 còn trong NH4+ thì N có cộng hóa trị là 4.
Câu 16:
22/07/2024Trong phân tử HNO3, nguyên tử N có:
 Xem đáp án
Xem đáp án
Đáp án C
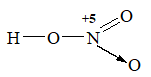
Vì xung quanh N có 4 liên kết nên N có cộng hóa trị là 4.
Câu 17:
17/07/2024Axit nitric mới điều chế không màu, khi để lâu ngày:
 Xem đáp án
Xem đáp án
Đáp án A
Axit nitric kém bền. Ngay ở điều kiện thường, khi có ánh sáng, dung dịch axit nitric đặc bị phân hủy một phần giải phóng khí nitơ đioxit. Khí này tan trong dd axit làm dd có màu vàng.
4HNO3→4 NO2+ O2+ 2H2O
Câu 18:
18/07/2024Khi cho kim loại Mg tác dụng với HNO3, sau phản ứng không thấy xuất hiện khí. Tổng số hệ số của các chất (là các số nguyên tối giản) có trong phương trình khi cân bằng là:
 Xem đáp án
Xem đáp án
Đáp án B
Khi cho kim loại Mg tác dụng với HNO3, sau phản ứng không thấy xuất hiện khí.
→ Sản phẩm khử là NH4NO3
PTHH:
4Mg+10 HNO3→ 4Mg(NO3)2+ NH4NO3+ 3H2O
→Tổng hệ số các chất là 22
Câu 19:
17/07/2024Để điều chế 50 ml dung dịch HNO3 0,1M cần dùng một thể tích khí NH3 (đktc) là:
 Xem đáp án
Xem đáp án
Đáp án B
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
2NO + O2→ 2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có:
nNH3= nHNO3=0,05.0,1=5.10-3 mol
→ VNH3=0,112 lít=112 ml
Câu 20:
23/07/2024Tính khối lượng dung dịch HNO3 60% điều chế được từ 112 000 lít khí NH3 (đktc). Giả thiết hiệu suất của cả quá trình là 80%?
 Xem đáp án
Xem đáp án
Đáp án C
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
2NO + O2→2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có:
nHNO3=nNH3=112 000/22,4=5000 mol
→mHNO3=315 000 gam= 315 kg
→ mddHNO3= 315.100/60=525 kg
Do hiệu suất bằng 80% nên mddHNO3 thực = mPT.80/100= 525.80/100=420 kg
Bài thi liên quan
-
100 câu trắc nghiệm Nito - Photpho cơ bản (Đề 1)
-
20 câu hỏi
-
40 phút
-
-
100 câu trắc nghiệm Nito - Photpho cơ bản (Đề 2)
-
20 câu hỏi
-
40 phút
-
-
100 câu trắc nghiệm Nito - Photpho cơ bản (Đề 3)
-
20 câu hỏi
-
40 phút
-
-
100 câu trắc nghiệm Nito - Photpho cơ bản (Đề 5)
-
20 câu hỏi
-
40 phút
-
Có thể bạn quan tâm
- 100 câu trắc nghiệm Nito - Photpho cơ bản (1183 lượt thi)
- 100 câu trắc nghiệm Nito - Photpho nâng cao (1979 lượt thi)
Các bài thi hot trong chương
- Trắc nghiệm Amoniac và muối amoni có đáp án (Thông hiểu) (1293 lượt thi)
- Trắc nghiệm Nitơ (có đáp án) (639 lượt thi)
- Trắc nghiệm Amoniac và muối amoni có đáp án (Nhận biết) (579 lượt thi)
- Trắc nghiệm Axit nitric và muối nitrat có đáp án (Nhận biết) (544 lượt thi)
- Trắc nghiệm Phân bón hóa học (có đáp án) Hóa học lớp 11 (528 lượt thi)
- Trắc nghiệm Axit nitric và muối nitrat (có đáp án) (520 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất hóa học của nitơ, photpho và hợp chất của chúng (có đáp án) (475 lượt thi)
- Trắc nghiệm Axit nitric và muối nitrat có đáp án (Vận dụng) (439 lượt thi)
- Trắc nghiệm Axit photphoric và muối photphat (có đáp án) (427 lượt thi)
- Trắc nghiệm Photpho (có đáp án) (416 lượt thi)
