Chuyên đề Hóa 10 Bài 4 (Chân trời sáng tạo): Entropy và biến thiên năng lượng tự do Gibbs
Với giải bài tập Chuyên đề Hóa 10 Bài 4: Entropy và biến thiên năng lượng tự do Gibbs sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Chuyên đề học tập Hóa 10 CTST Bài 4.
Giải bài tập Chuyên đề Hóa 10 Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
A/ Câu hỏi đầu bài
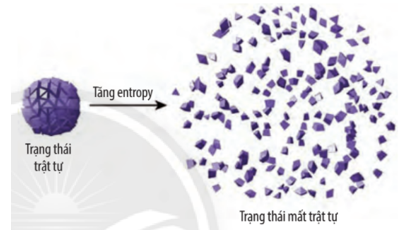
Mở đầu trang 22 Chuyên đề Hóa học 10: Nếu một lọ nước hoa được mở, chúng ta sẽ ngửi được mùi thơm từ xa, do các phân tử của thành phần nước hoa khuếch tán vào không khí, đó là quá trình tự xảy ra. Ngược lại, để thu hồi các phân tử nước hoa đó vào trong lọ như trạng thái ban đầu thì không thể thực hiện được. Đó là quá trình không tự xảy ra. Các phản ứng Hóa học cũng tương tự như vậy, có phản ứng tự xảy ra và có phản ứng không tự xảy ra. Các quá trình trong tự nhiên có xu hướng xảy ra theo chiều tăng độ mất trật tự (hỗn loạn) của các tiểu phân trong hệ, người ta gọi đó là quá trình tăng entropy. Entropy là gì? Entropy ảnh hưởng như thế nào đến chiều hướng diễn biến của phản ứng Hóa học?
Trả lời:
Entropy là đại lượng đặc trưng cho độ mất trật tự của một hệ ở một trạng thái và điều kiệu xác định. Entropy càng lớn hệ càng mất trật tự.
= - T.
< 0: phản ứng tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
> 0: phản ứng không tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
= 0: phản ứng đạt trạng thái cân bằng (phản ứng đồng thời xảy ra theo hai chiều ngược nhau với tốc độ như nhau).
B/ Câu hỏi giữa bài
1. Entropy

Trả lời:
Khi tăng nhiệt độ, độ mất trật tự (hỗn loạn) của các tiểu phân trong hệ tăng.
⇒ Entropy của hệ tăng.

Trả lời:
Các phân tử chất ở trạng thái rắn, lỏng, khí có độ mất trật tự (hỗn loạn) tăng theo chiều:
Rắn < lỏng < khí.
Vì vậy chuyển thể của chất từ trạng thái rắn sang lỏng và khí thì entropy của chất tăng.
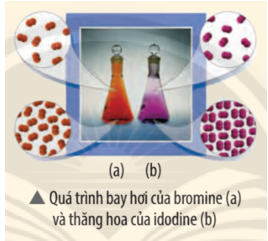
Trả lời:
Quá trình (a) bromine chuyển từ thể lỏng sang thể hơi ⇒ Độ hỗn loạn của các phân tử chất tăng ⇒ Entropy tăng.
Quá trình (b) iodine chuyên từthể rắn sang thể hơi ⇒ Độ hỗn loạn của các phân tử chất tăng ⇒ Entropy tăng.
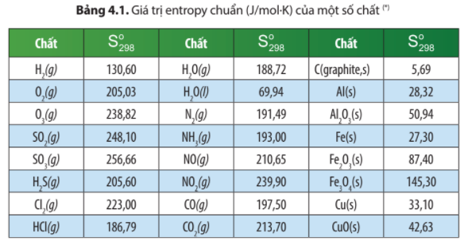
2. Biến thiên entropy trong phản ứng Hóa học
và so sánh giá trị của phản ứng này với phản ứng ở ví dụ 1. Giải thích.
b) C(graphite, s) + O2(g) → CO2(g)
Giải thích tại sao giá trị này lại lớn hơn 0 không đáng kể.
Trả lời:
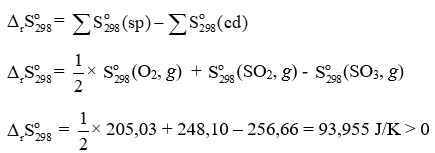
⇒ Phản ứng phân hủy SO3 làm tăng độ mất trật tự của hệ.
Ở ví dụ 1, phản ứng tổng hợp SO3 có = -93,95 J/K < 0
⇒ Phản ứng làm giảm độ mất trật tự của hệ.
3. Biến thiên năng lượng tự do Gibbs
Trả lời:
Hòa tan vôi sống (CaO) vào nước là phản ứng tỏa nhiệt
∆H của phản ứng mang dấu âm hay ∆H < 0.
Trả lời:
Na(s) + H2O(l) → NaOH(aq) + H2(g)
Ta thấy phản ứng Hóa học làm tăng số mol khí ⇒ > 0.
Mặt khác phản ứng làm tăng nhiệt độ của nước trong chậu nên < 0
⇒ = - T. < 0
⇒ Phản ứng tự xảy ra một cách dễ dàng.
Bài tập

Trả lời:
Quá trình này làm tăng độ mất trật tự của hệ ⇒ Làm tăng entropy.
e) Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Trả lời:
Lưu ý:
- Các phản ứng Hóa học làm tăng số mol khí thường có biến thiên entropy dương (∆S > 0).
- Các phản ứng Hóa học làm giảm số mol khí thường có biến thiên entropy âm (∆S < 0)
- Các phản ứng Hóa học không làm thay đổi số mol khí hoặc phản ứng không có chất khí sẽ có biến thiên entropy nhỏ (∆S ≈ 0)
a) Phản ứng làm tăng số mol khí ⇒ ∆S > 0
b) Phản ứng làm giảm số mol khí ⇒ ∆S < 0
c) Phản ứng có số mol khí trước và sau phản ứng bằng nhau ⇒ ∆S ≈ 0
d) Phản ứng có số mol khí trước và sau phản ứng bằng nhau ⇒ ∆S ≈ 0
e) Phản ứng làm tăng số mol khí ⇒ ∆S > 0
Bài tập 3 trang 32 Chuyên đề Hóa học 10: Cho phản ứng Hóa học:
CO2(g) → CO(g) + O2(g) và các dữ kiện:
a) Ở điều kiện chuẩn và 25oC phản ứng trên có tự xảy ra được không?
Trả lời:
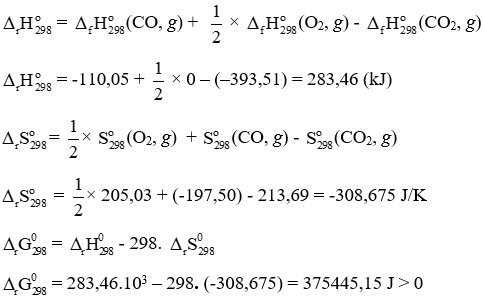
⇒ Phản ứng trên không tự xảy ra.
b) Để phản ứng trên tự xảy ra, cần có:
= - T. < 0
⇔ 283,46.103 – T. (-308,675) < 0
⇔ T > 918 K hay T > 645 oC
Xem thêm lời giải Chuyên đề Hóa học lớp 10 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Sơ lược về phản ứng cháy và nổ
Bài 6: Điểm chớp cháy, nhiệt độ tự bốc cháy và nhiệt độ cháy
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo
