Chuyên đề Hóa 10 Bài 7 (Chân trời sáng tạo): Hóa học về phản ứng cháy nổ
Với giải bài tập Chuyên đề Hóa 10 Bài 7: Hóa học về phản ứng cháy nổ sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Chuyên đề học tập Hóa 10 CTST Bài 7.
Giải bài tập Chuyên đề Hóa 10 Bài 7: Hóa học về phản ứng cháy nổ
A/ Câu hỏi đầu bài

Trả lời:
- Tính biến thiên enthalpy của phản ứng cháy, nổ theo năng lượng liên kết.
ΔrHo298=∑Eb(cd)−∑Eb(sp)
- Tính biến thiên enthapy của phản ứng cháy, nổ theo nhiệt hình thành chuẩn của các chất
ΔrHo298=∑ΔfHo298(sp)−∑ΔfHo298(cd)
- Các yếu tố ảnh hưởng đến tốc độ phản ứng cháy:
+ Chất cháy.
+ Chất oxi hóa (oxygen)
+ Nguồn nhiệt
B/ Câu hỏi giữa bài
1. Biến thiên enthalpy (ΔrHo) của một số phản ứng cháy, nổ
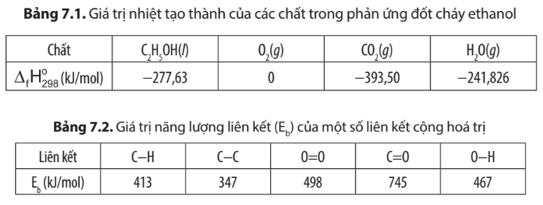
Trả lời:
Phản ứng đốt cháy ethanol:
C2H5OH(l) + 3O2(g) →t° 2CO2(g) + 3H2O(g)
= 2.(CO2, g) + 3.(H2O, g) - (C2H5OH, l) – 3.(O2, g)
= 2.(-393,50) + 3.(-241,826) – (-277,63) – 3.0 = -1234,85 kJ
Phản ứng đốt cháy 1 mol propane:
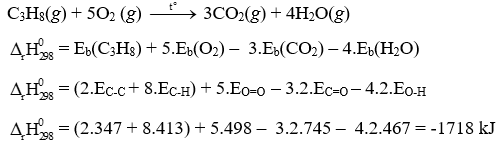
Phản ứng đốt cháy 1 mol butane:
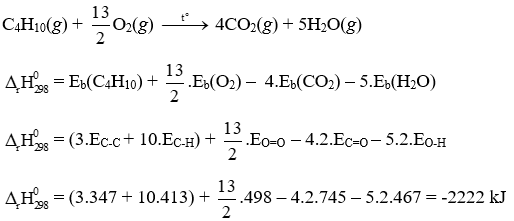
Biến thiên enthalpy phản ứng đốt cháy 1 mol khí gas chứa propane (40%) và butane (60%) là: = (-1718).0,4 + (-2222).0,6 = -2020,4 kJ
Trả lời:
Phản ứng đốt cháy 1 mol octane:
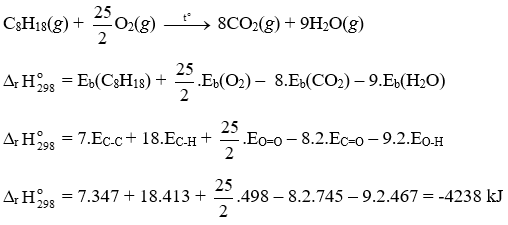
Đốt cháy 1 mol C8H18(g) tỏa ra 4238 kJ nhiệt lượng
Phản ứng đốt cháy 1 mol methane
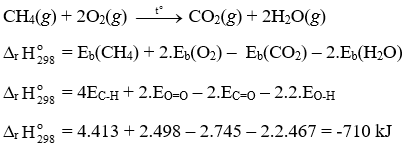
Đốt cháy 1 mol CH4(g) tỏa ra 710 kJ nhiệt lượng
Như vậy nhiệt lượng tỏa ra khi đốt cháy octane lớn hơn nhiều so với đốt cháy methane. Hay phản ứng đốt cháy octane xảy ra mãnh liệt hơn phản ứng đốt cháy methane.
2. Tốc độ phản ứng cháy
Trả lời:
Lấy 100 L không khí có 20,9 L oxygen
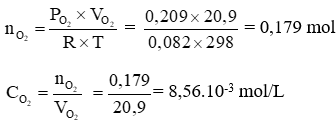
Trả lời:
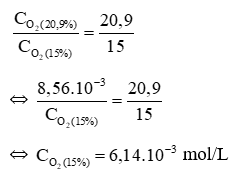
Trả lời:
Từ biểu thức tính tốc độ phản ứng cháy của thanh đá: v = k × cho thấy nếu nồng độ oxygen giảm bao nhiêu lần thì tốc độ phản ứng giảm đi bấy nhiêu lần.
Tốc độ phản ứng cháy tỉ lệ thuận với nồng độ oxygen.
lần
Như vậy tốc độ phản ứng cháy của than đá giảm chỉ còn bằng 0,72 lần so với ban đầu.
Trả lời:
Tốc độ “phản ứng hô hấp” phụ thuộc nồng độ oxygen theo phương trình tốc độ:
v = k ×
lần
Như vậy tốc độ “phản ứng hô hấp” của người ở trong phòng giảm chỉ còn bằng 0,81 lần so với ở ngoài phòng.
3. Nguyên tắc chữa cháy
Trả lời:
- Các yếu tố ảnh hưởng đến tốc độ phản ứng cháy:
+ Chất cháy.
+ Chất oxi hóa (oxygen)
+ Nguồn nhiệt
- Một số biện pháp dập tắt một đám cháy:
+ Đối với các đám cháy là chất rắn như gỗ, củi, rơm rạ ta có thể sử dụng nước làm giảm nhiệt độ của đám cháy xuống dưới nhiệt độ cháy, làm loãng khí cháy.
+ Đối với các đám cháy bằng xăng, dầu không dùng nước để dập tắt mà dùng cát (đối với đám cháy nhỏ) hoặc dùng bột chữa cháy chuyên dụng để dập tắt.
Trả lời:
|
Loại đám cháy |
Chất cháy |
Ví dụ |
|
Loại A |
Đám cháy các chất rắn (thông thường là các chất hữu cơ) khi cháy thường kèm theo sự tạo ra than hồng. |
Chất rắn bao gồm gỗ, giấy, vải, rác và vật liệu thông thường khác. |
|
Loại B |
Đám cháy các chất lỏng và chất rắn hóa lỏng |
Xăng, dầu, sơn,… |
|
Loại C |
Đám cháy các chất khí |
Khí tự nhiên, methane, hydrogen,… |
|
Loại D |
Đám cháy các kim loại |
Kim loại kiềm (Na, K, Li), kim loại kiềm thổ (Ca, Mg), nhôm (aluminium Al) |
|
Loại F |
Đám cháy dầu và mỡ của động vật hay thực vật trong các thiết bị nấu nướng |
Dầu ăn, mỡ,… |
Trả lời:
Không được dùng nước để dập tắt đám cháy xăng, dầu vì xăng, dầu nhẹ hơn nước và không tan trong nước. Nếu dùng nước sẽ khiến xăng, dầu theo nước loang rộng ra, làm đám cháy lan rộng và khó dập tắt hơn.
Trả lời:
- Không sử dụng nước để dập tắt các đám cháy bằng kim loại hoạt động mạnh như kim loại kiềm, kiềm thổ và nhôm,...Vì các kim loại này có khả năng tác dụng với nước giải phóng hydrogen, dẫn đến xảy ra một vụ nổ hơi làm văng các kim loại này đi khắp nơi dẫn đến đám cháy lan rộng. Hơn nữa, một số kim loại khi bị đốt nóng sẽ phân tách nước thành oxygen và hydrogen có thể tạo ra một vụ nổ hydrogen lớn.
- Không dùng khí CO2 để chữa đám cháy magie vì khi magie cháy nếu có mặt CO2 sẽ xảy ra phản ứng: 2Mg + CO2 → 2MgO + C. Phản ứng trên tỏa nhiệt rất mạnh và tạo ra muội than. Muội than này tiếp tục cháy và làm cho đám cháy càng khó kiểm soát.
- Không dùng cát để chữa đám cháy kim loại magie vì magie có thể phản ứng với SiO2 thành phần chính có trong cát, làm đám cháy càng khó kiểm soát.
- Không dùng bọt chữa cháy, vì chúng sẽ tiếp tục cháy do có phản ứng với không khí và nước có trong bọt.
Mg + H2O MgO + H2
- Không dùng bột chữa cháy có chứa NaHCO3 vì khi nhiệt độ cao sẽ phân hủy thành CO2 và lại tiếp tục phản ứng với Mg khiến đám cháy lan rộng hơn.
Mg + CO2 MgO + C
Bài tập
Bài tập 1 trang 47 Chuyên đề Hóa học 10: Tốc độ phản ứng cháy phụ thuộc nồng độ oxygen. Khi nồng độ oxygen giảm thì tốc độ phản ứng cháy thay đổi như thế nào?
Trả lời:
Khi nồng độ oxygen giảm thì tốc độ phản ứng cháy giảm và ngược lại.
Bài tập 2 trang 47 Chuyên đề Hóa học 10: Tốc độ phản ứng hô hấp phụ thuộc nồng độ oxygen. Khi nồng độ oxygen tăng thì tốc độ “phản ứng hô hấp” thay đổi như thế nào?
Trả lời
Khi nồng độ oxygen giảm thì tốc độ “phản ứng hô hấp” giảm và ngược lại.
Bài tập 3 trang 47 Chuyên đề Hóa học 10: Không khí trên đỉnh ngọn núi cao rất loãng. Điều này có thể gây ảnh hưởng xấu đến những người leo núi. Vì vậy, những nhà leo núi luôn trang bị bình dưỡng khí khi họ leo lên những đỉnh núi cao. Giả sử không khí trên đỉnh núi đó có 16% oxygen theo thể tích. Tốc độ “phản ứng hô hấp” tăng hay giảm bao nhiêu lần so với nơi mà không khí có 20,9% oxygen theo thể tích?
Trả lời:
Tốc độ “phản ứng hô hấp” phụ thuộc nồng độ oxygen theo phương trình tốc độ:
v = k ×
lần
Như vậy tốc độ “phản ứng hô hấp” của người khi ở trên đỉnh núi giảm chỉ còn bằng 0,77 lần so với nơi mà không khí có 20,9% oxygen theo thể tích.
Bài tập 4 trang 47 Chuyên đề Hóa học 10: Hãy kể tên một số chất có thể sử dụng để dập tắt đám cháy khi xảy ra hỏa hoạn ở
Trả lời:
a) Đối với chất cháy loại A (gỗ, củi) ta có thể sử dụng các hóa chất như nước, carbon dioxide (CO2), chất chữa cháy dạng bọt, bột khô (NaHCO3) để dập tắt.
b) Đối với chất cháy loại B (xăng, dầu) ta có thể sử dụng các hóa chất như carbon dioxide (CO2), chất chữa cháy dạng bọt, bột khô (NaHCO3) để dập tắt. Tuyệt đối không dùng nước.
Trả lời:
Dùng một chiếc chăn thấm ướt hoặc cát để dập tắt đám cháy có tác dụng ngăn ngọn lửa tiếp xúc với khí oxygen, phá vỡ một tác nhân gây cháy trong tam giác lửa.

Xem thêm lời giải Chuyên đề Hóa học lớp 10 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Sơ lược về phản ứng cháy và nổ
Bài 6: Điểm chớp cháy, nhiệt độ tự bốc cháy và nhiệt độ cháy
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo
