Chuyên đề Hóa 10 Bài 1 (Chân trời sáng tạo): Liên kết hóa học
Với giải bài tập Chuyên đề Hóa 10 Bài 1: Liên kết hóa học sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Chuyên đề học tập Hóa 10 CTST Bài 1.
Giải bài tập Chuyên đề Hóa 10 Bài 1: Liên kết hóa học
A/ Câu hỏi đầu bài
Yếu tố nào quyết định hình học phân tử các chất?
Trả lời:
Hình học một số phân tử chỉ phụ thuộc vào tổng số các cặp electron hóa trị (liên kết và chưa liên kết) của nguyên tử trung tâm.
B/ Câu hỏi giữa bài
1. Công thức Lewis
Trả lời:
- Công thức Lewis của nguyên tử oxygen:
![]()
- Công thức Lewis của nguyên tử magnesium:
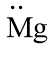
Trả lời:
Công thức electron của CH4 là:
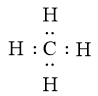
Viết công thức Lewis của nitrogen trichloride.
Trả lời:
Bước 1: Tổng số electron hóa trị của phân tử NCl3 là:
5 + 7.3 = 26
Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử NCl3:
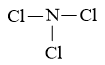
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
26 – 2.3 = 20
Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn trong sơ đồ (Cl có độ âm điện lớn hơn.
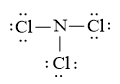
Số electron hóa trị còn lại: 20 – 6.3 = 2
Nguyên tử trung tâm N chưa đạt octet, dùng 2 electron còn lại tạo octet cho N.
Công thức Lewis của nitrogen trichloride (NCl3) là:
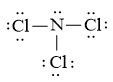
Trả lời:
B có 3 electron hóa trị, F có 7 electron hóa trị. Trong phân tử BF3 có 1 nguyên tử B và 3 nguyên tử F
⇒ Tổng số electron hóa trị là: 1.3 + 3.7 = 24 electron
Trả lời:
B có độ âm điện nhỏ hơn F nên B là nguyên tử trung tâm.
Sơ đồ khung của phân tử BF3:
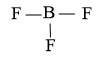
Trả lời:
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
24 – 2 × 3 = 18 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
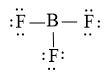
Số electron hóa trị còn lại: 18 – 18 = 0
Vì nguyên tử B chưa đạt octet nên vẫn cần thực hiện bước 4.
Bước 4: Nguyên tử B chưa được octet nên ta chuyển 1 cặp electron chưa liên kết của F tạo cặp electron chung
Vậy công thức Lewis của BF3
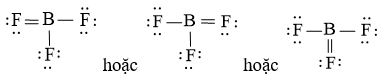
Luyện tập trang 7 Chuyên đề Hóa học 10: Viết công thức Lewis của phân tử CCl4.
Trả lời:
Bước 1: C có 4 electron hóa trị, Cl có 7 electron hóa trị. Trong phân tử CCl4 có 1 nguyên tử C và 4 nguyên tử Cl.
⇒ Tổng số electron hóa trị của phân tử CCl4 là: 1.4 + 4.7 = 32 electron
Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử CCl4
C có độ âm điện nhỏ hơn nên C là nguyên tử trung tâm.
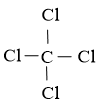
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 32 – 2 × 4 = 24 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 24 electron này để tạo octet cho Cl trước (vì Cl có độ âm điện cao hơn)
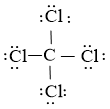
Bước 4: Nguyên tử C đã được octet. Vậy công thức Lewis của CCl4 là
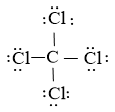
2. Hình học một số phân tử
Trả lời:
Công thức Lewis của H2O là
![]()
Phân tử nước có 2 cặp electron chung và 2 cặp electron riêng ở nguyên tử trung tâm (nguyên tử O).
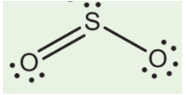
Trả lời:
Dựa vào công thức Lewis của SO2 ta thấy:
+ n là số nguyên tử O liên kết với nguyên tử trung tâm S ⇒ n = 2.
+ m là số cặp electron riêng của nguyên tử trung tâm ⇒ m = 1.
Hình thành kiến thức mới 8 trang 7 Chuyên đề Hóa học 10: Viết công thức VSEPR của H2O, NH3 và SO2
Trả lời:
- Từ công thức Lewis của H2O
![]()
⇒ Công thức VSEPR của H2O là: AX2E2
- Từ công thức Lewis của NH3
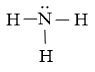
⇒ Công thức VSEPR của NH3 là: AX3E1
- Từ công thức Lewis của SO2
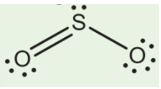
⇒ Công thức VSEPR của SO2 là AX2E1.
Luyện tập trang 8 Chuyên đề Hóa học 10: Sử dụng mô hình VSEPR để dự đoán hình học của phân tử CS2.
Trả lời:
Công thức Lewis của CS2
![]()
⇒ Công thức VSEPR của CS2 là: AX2
Xung quanh nguyên tử C có hai cặp electron chung (hai liên kết đôi), để giảm tối ta lực đẩy 2 cặp electron này phải chiếm 2 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất
→ Phân tử CS2 có dạng đường thẳng theo mô hình VSEPR, góc hóa trị liên kết là 180o
3. Sự lai hóa orbital nguyên tử
Trả lời:
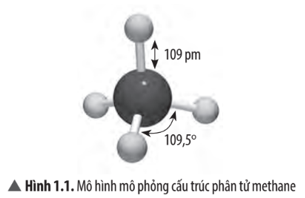
Vì xung quanh nguyên tử C có 4 cặp electron chung. Để giảm tối đa lực đẩy giữa 4 cặp electron chung, 4 cặp electron này phải chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất nên phân tử có dạng tứ diện, góc liên kết = 109,5o
Trả lời:
Các orbital nguyên tử lai hóa có năng lượng bằng nhau, hình dạng, kích thước giống nhau.
Trả lời:
Số AO lai hóa bằng tổng số AO tham gia lai hóa nên nếu có 3 AO tham gia lai hóa sẽ tạo ra 3 AO lai hóa.
Trả lời:
Công thức Lewis của CO2
![]()
Công thức VSEPR của CO2 có dạng AX2
Từ công thức Lewis của CO2 ta xác định được phân tử này có dạng đường thẳng theo mô hình VSEPR.
Cấu hình electron của C (Z = 6) là 1s22s22p2.
1 AO 2s tổ hợp với 1 AO 2p, tạo 2 AO lai hóa sp
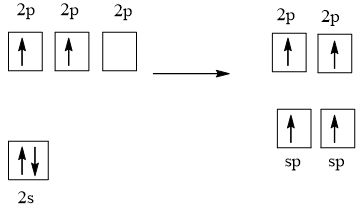
2 AO lai hóa này xen phủ trục với 2 AO 2p chứa electron độc thân của 2 nguyên tử O tạo thành liên kết σ.
Hai AO 2p không lai hóa của nguyên tử C có chứa electron độc thân xen phủ bên với 2AO 2p chứa electron độc thân còn lại của 2 nguyên tử O, tạo nên 2 liên kết π.
Trả lời:
Cấu hình electron của C (Z = 6) là 1s22s22p2.
1 AO 2s tổ hợp với 2 AO 2p tạo 3 AO lai hóa sp2.
Vậy nguyên tử C trong phân tử formaldehyde lai hóa sp2
- Xác định số nguyên tử liên kết trực tiếp với A.
- Xác định số cặp electron hóa trị riêng của A.
- Nếu tổng hai giá trị là 2; 3 hoặc 4 thì trạng thái lai hóa của A lần lượt là sp; sp2 hoặc sp3
Dự đoán trạng thái lai hóa của nguyên tử C, S và N trong các phân tử CO2, SO2 và NH3
Trả lời:
Trong phân tử CO2
- Số nguyên tử liên kết với C là 2.
- Số cặp electron hóa trị riêng của C là 0
- Tổng hai giá trị là 2 ⇒ Trạng thái lai hóa của C là sp.
Trong phân tử SO2
- Số nguyên tử liên kết với S là 2.
- Số cặp electron hóa trị riêng của S là 1
- Tổng hai giá trị là 3 ⇒ Trạng thái lai hóa của S là sp2.
Trong phân tử NH3
- Số nguyên tử liên kết với N là 3.
- Số cặp electron hóa trị riêng của N là 1
- Tổng hai giá trị là 4 ⇒ Trạng thái lai hóa của N là sp3.
Trả lời:
Phân tử chứa nguyên tử lai hóa sp3 không thể có cấu trúc phẳng. Vì khi 1 AO ns tổ hợp với 3 AO np tạo ra 4 AO lai hóa sp3. 4 AO sp3 này chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất nên phân tử có dạng tứ diện, góc tạo bởi hai trục của hai AO là 109,5o.
Ví dụ phân tử CH4
Từ công thức Lewis của CH4 ta xác định được phân tử này có dạng tứ diện theo mô hình VSEPR.
Cấu hình electron của C (Z = 6) là 1s22s22p2
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
4 AO lai hóa sp3 của nguyên tử C xen phủ với 4 AO s của nguyên tử H tạo thành 4 liên kết σ hướng về 4 đỉnh của một tứ diện đều.
Trả lời:
Cấu hình electron của O (Z = 8) là 1s22s22p4
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
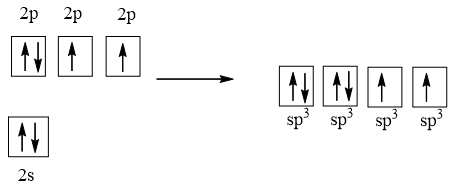
2 AO lai hóa sp3 chứa electron độc thân của nguyên tử O xen phủ với 2 AO s của nguyên tử H tạo thành 2 liên kết σ.
Bài tập
Bài tập 1 trang 12 Chuyên đề Hóa học 10: Viết công thức Lewis của các phân tử sau:
Trả lời:
a) Viết công thức Lewis của HCN
Bước 1: C có 4 electron hóa trị, H có 1 electron hóa trị, N có 5 electron hóa trị.
⇒ Tổng số electron hóa trị là: 4 + 1 + 5 = 10 electron.
Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử HCN
![]()
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 10 – 2 × 2 = 6 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 6 electron này để tạo octet cho N trước
![]()
Bước 4: Đã sử dụng hết 6 electron để tạo octet cho N. Tuy nhiên C chưa đủ octet nên ta chuyển 2 cặp electron của nguyên tử N tạo thành cặp electron dùng chung giữa C và N. Nguyên tử H đã đủ octet
Vậy công thức Lewis của HCN là:
![]()
b) Viết công thức Lewis của SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị là: 1.6 + 3.6 = 24 electron
Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử SO3
S có độ âm điện nhỏ hơn nên S là nguyên tử trung tâm.
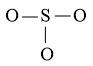
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 24 – 2 × 3 = 18 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 18 electron này để tạo octet cho O trước (vì O có độ âm điện cao hơn)
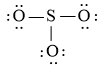
Bước 4: Đã sử dụng hết 18 electron để tạo octet cho O. Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
Vậy công thức Lewis của SO3 là:
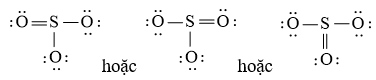
Trả lời:
a) Công thức Lewis của HCN là:
![]()
⇒ Công thức VSEPR của HCN là AX2
⇒ HCN có dạng đường thẳng
b) Từ công thức Lewis của SO3
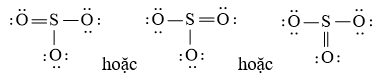
⇒ Công thức VSEPR của SO3 là: AX3
⇒ SO3 có dạng tam giác phẳng.
c) Công thức Lewis của PH3 là
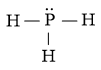
⇒ Công thức VSEPR của PH3 là: AX3E1
⇒ Để giảm tối đa lực đẩy giữa 4 cặp electron hóa trị (gồm 3 cặp electron chung và 1 cặp electron riêng), 4 cặp electron này phải chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất. Tuy nhiên cặp electron riêng đẩy mạnh hơn làm góc liên kết giảm, nên nhỏ hơn 109,5o
Trả lời:
a) Công thức Lewis của C2H2 là:
![]()
Cấu hình electron của nguyên tử C là: 1s22s22p2
1 AO 2s tổ hợp với 1 AO 2p, tạo 2 AO lai hóa sp
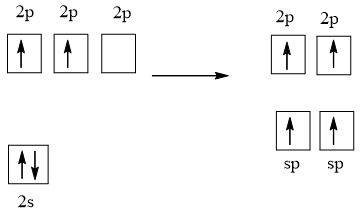
Mỗi nguyên tử C ở trạng thái lai hóa sp. Mỗi nguyên tử C dùng 1 AO lai hóa sp để xen phủ với nhau tạo ra liên kết σC-C. Mỗi nguyên tử C dùng AO lai hóa sp còn lại để xen phủ với AO 1s của một nguyên tử H tạo ra liên kết σC-H. Mỗi nguyên tử C còn lại 2 AO 2p song song từng đôi một. Chúng xen phủ bên với nhau tạo ra 2 liên kết πC-C. Như vậy trong phân tử C2H2 có 3 liên kết σ và 2 liên kết π.
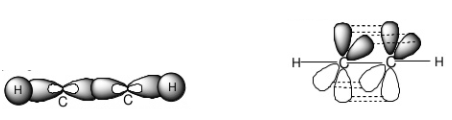
b) Công thức Lewis của C2H4 là:
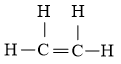
Cấu hình electron của nguyên tử C là: 1s22s22p2
1 AO 2s tổ hợp với 2 AO 2p tạo 3 AO lai hóa sp2.
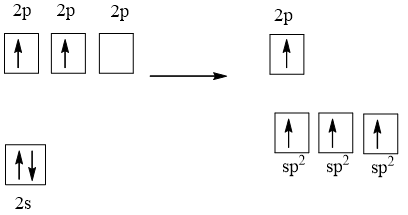
Trong phân tử C2H4 mỗi nguyên tử C có sự lai hóa sp2. Mỗi nguyên tử C dùng 1 AO lai hóa để xen phủ với nhau tạo ra liên kết σC-C. Mỗi nguyên tử C dùng AO lai hóa còn lại để xen phủ với AO 1s của một nguyên tử H tạo ra liên kết σC-H. Mỗi nguyên tử C còn 1 AO p không tham gia lai hóa sẽ xen phủ bên với nhau tạo liên kết πC-C. Như vậy trong phân tử C2H4 có 5 liên kết σ và 1 liên kết π.
c) Công thức Lewis của NH3 là:
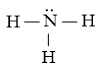
⇒ Công thức VSEPR của NH3 là: AX3E1
Từ công thức VSEPR dự đoán được trạng thái lai hóa của nguyên tử N trong phân tử NH3 là sp3.
Cấu hình electron của N là: 1s22s22p3
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
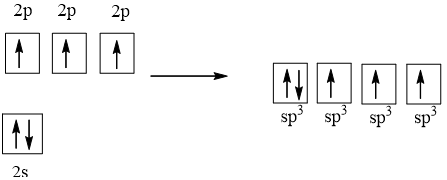
Ba AO lai hóa sp3 (chứa electron độc thân) của nguyên tử N xen phủ với AO 1s của 3 nguyên tử H, tạo va liên kết σ, hướng về ba đỉnh của hình tứ diện. Nguyên tử N còn 1 AO lai hóa sp3 chứa một cặp electron chưa liên kết nằm hướng về đỉnh còn lại của tứ diện. Tuy nhiên cặp electron chưa liên kết này đẩy mạnh hơn nên làm góc liên kết giảm, nên nhỏ hơn 109,5o
Trả lời:
Lưu ý: Có thể dự đoán nhanh trạng thái lai hóa của nguyên tử A (nguyên tố s, p) trong một phân tử bất kì như sau:
- Xác định số nguyên tử liên kết trực tiếp với A.
- Xác định số cặp electron hóa trị riêng của A.
- Nếu tổng hai giá trị là 2; 3 hoặc 4 thì trạng thái lai hóa của A lần lượt là sp; sp2 hoặc sp3
a) Trong phân tử PCl3
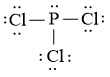
- Số nguyên tử liên kết với P là 3.
- Số cặp electron hóa trị riêng của P là 1
- Tổng hai giá trị là 4 ⇒ Trạng thái lai hóa của C là sp3.
b) Trong phân tử CS2
![]()
- Số nguyên tử liên kết với C là 2.
- Số cặp electron hóa trị riêng của C là 0
- Tổng hai giá trị là 2 ⇒ Trạng thái lai hóa của C là sp.
c) Trong phân tử SO2
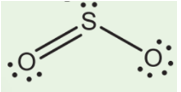
- Số nguyên tử liên kết với S là 2.
- Số cặp electron hóa trị riêng của S là 1
- Tổng hai giá trị là 3 ⇒ Trạng thái lai hóa của S là sp2.
Xem thêm lời giải Chuyên đề Hóa học lớp 10 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 3: Năng lượng hoạt hóa của phản ứng hóa học
Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Bài 5: Sơ lược về phản ứng cháy và nổ
Bài 6: Điểm chớp cháy, nhiệt độ tự bốc cháy và nhiệt độ cháy
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo

