Chuyên đề Hóa 10 Bài 3 (Chân trời sáng tạo): Năng lượng hoạt hóa của phản ứng hóa học
Với giải bài tập Chuyên đề Hóa 10 Bài 3: Năng lượng hoạt hóa của phản ứng hóa học sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Chuyên đề học tập Hóa 10 CTST Bài 3.
Giải bài tập Chuyên đề Hóa 10 Bài 3: Năng lượng hoạt hóa của phản ứng hóa học
A/ Câu hỏi đầu bài
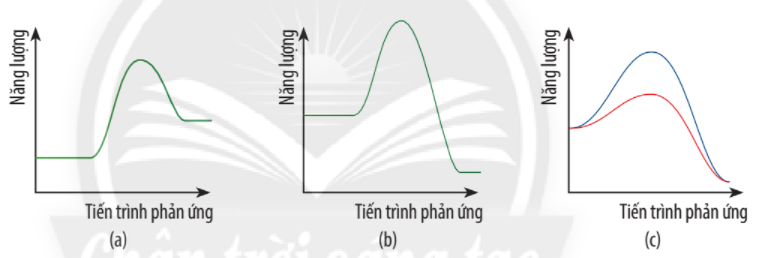
Trả lời:
Chất xúc tác có vai trò làm giảm năng lượng hoạt hóa để tăng tốc độ phản ứng.
B/ Câu hỏi giữa bài
1. Năng lượng hoạt hóa
Trả lời:
Năng lượng hoạt hóa càng giảm thì số va chạm hiệu quả càng giảm và khả năng xảy ra phản ứng của chất tham gia càng giảm.
Khi năng lượng hoạt hóa giảm đến dưới mức năng lượng tối thiểu thì các chất tham gia phản ứng không tạo ra được các va chạm hiệu quả dẫn đến không hình thành được sản phẩm.
Trả lời:
Từ thông tin trong phần Khởi động, khi có chất xúc tác làm tăng tốc độ của phản ứng tức là sẽ có nhiều hơn số phân tử chất phản ứng va chạm hiệu quả với nhau dẫn đến năng lượng hoạt hóa giảm.
Trả lời:
Khi năng lượng hoạt hóa của phản ứng rất lớn chứng tỏ các phân tử chất phản ứng va chạm hiệu quả với nhau khó khăn dẫn đến khả năng xảy ra của phản ứng Hóa học đó là khó khăn.
2. Ảnh hưởng của năng lượng hoạt hóa và nhiệt độ đến tốc độ phản ứng
Trả lời:
Dựa vào phương trình Arrhenius, tốc độ phản ứng tại thời điểm T1 là:
(1)
Tốc độ phản ứng tại thời điểm T2 là:
(2)
Chia hai vế phương trình (2) cho (1), thu được:
Khi tăng nhiệt độ tức là T2 > T1
⇒ > 1 ⇒ Tốc độ phản ứng tăng.
Trả lời:
Dựa vào phương trình Arrhenius ta có:
⇔
⇔ hay
Vậy, khi giảm nhiêt độ về 25oC thì tốc độ phản ứng giảm 13,84 lần.
Trả lời:
Dựa vào phương trình Arrhenius, tốc độ phản ứng tại thời điểm T1 là:
(1)
Tốc độ phản ứng tại thời điểm T2 là:
(2)
Chia hai vế phương trình (2) cho (1), thu được:
Hay
Thay số vào ta được:
⇔ = 11,08
Vậy khi tăng nhiệt độ từ 27oC lên 127oC thì tốc độ phản ứng tăng 11,08 lần.
Trả lời:
Enzyme là chất xúc tác sinh học, có vai trò làm tăng tốc độ phản ứng.
Mà theo phương trình Arrhenius, tốc độ phản ứng tăng thì năng lượng hoạt hóa của phản ứng giảm.
Vậy enzyme có vai trò làm giảm năng lượng hoạt hóa của phản ứng.
Trả lời:
+ H2 phản ứng vô cùng chậm với O2 ở nhiệt độ phòng, nhưng khi thổi khí H2 qua lưới kim loại platinum (Pt) trong không khí, H2 có thể bốc cháy. Trong trường hợp này, Pt đóng vai trò làm chất xúc tác cho phản ứng:
2H2 + O2 2H2O
+ Trong các nhà máy sản xuất phân đạm người ta thường dùng sắt làm chất xúc tác để tăng tốc độ phản ứng giữa nitrogen (N2) và hydrogen (H2)
N2 + 3H2 2NH3
+ Hỗn hợp bột aluminium và iodine ở nhiệt độ thường không có phản ứng xảy ra, nhưng khi cho thêm một ít nước làm xúc tác, phản ứng xảy ra mãnh liệt, tạo hợp chất aluminium iodine.
2Al + 3I2 2AlI3
Trả lời:
Trong dứa có một loại enzyme tên là enzyme bromelain, enzyme này có tác dụng phân giải protein thành các chuỗi peptit ngắn hơn.
Thịt được cấu tạo chủ yếu bởi protein, khi hầm chung với dứa, enzyme này trong dứa sẽ phân giải protein trong thịt, giúp nhanh mềm và dễ tiêu hóa, hấp thu hơn.
Bài tập
Bài tập 1 trang 26 Chuyên đề Hóa học 10: Cho giản đồ năng lượng của các phản ứng:
a) Hãy biểu diễn năng lượng hoạt hóa trên giản đồ năng lượng của phản ứng trong từng trường hợp.
b) Giản đồ năng lượng nào biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hóa của phản ứng?
Trả lời:
a) Trong giản đồ (c) Ea’ là năng lượng hoạt hóa của phản ứng khi không có xúc tác.
Ea là năng lượng hoạt hóa của phản ứng khi có xúc tác.
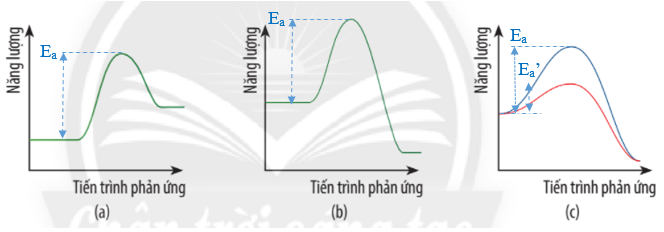
b) Giản đồ (c) biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hóa của phản ứng.
Đường màu xanh là năng lượng hoạt hóa khi không có xúc tác.
Đường màu đỏ là năng lượng hoạt hóa khi có xúc tác.
Trả lời:
Áp dụng phương trình Arrhenius:
⇔ ⇒ Ea = 1715 kJ/mol
Bài tập 3 trang 26 Chuyên đề Hóa học 10: Tìm hằng số tốc độ phản ứng k ở 273 K của phản ứng phân hủy
Biết rằng ở 300K, năng lượng hoạt hóa là 111 kJ/mol và hằng số tốc độ phản ứng là
Trả lời:
Áp dụng phương trình Arrhenius viết lại cho hai nhiệt độ
T1 = 300K; T2 = 273K ứng với hai hằng số tốc độ k1 = 10-10s-1; k2 = ?
⇔
⇔ k2 = 1,23.10-12s-1
Vậy hằng số tốc độ phản ứng ở 273 K của phản ứng phân hủy là k2 = 1,23.10-12 s-1
Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ từ 350oC lên 450oC.
Biết năng lượng hoạt hóa của phản ứng là 314 kJ/mol.
Trả lời:
Áp dụng phương trình Arrhenius theo nhiệt độ:
Thay số vào ta được:
⇔ = 4380,03
Vậy khi tăng nhiệt độ từ 350oC lên 450oC thì tốc độ phản ứng tăng 4380,03 lần.
Xem thêm lời giải Chuyên đề Hóa học lớp 10 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Bài 5: Sơ lược về phản ứng cháy và nổ
Bài 6: Điểm chớp cháy, nhiệt độ tự bốc cháy và nhiệt độ cháy
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo