Lý thuyết Hóa học 10 Bài 12 (Cánh diều): Liên kết hydrogen và tương tác Van Der Waals
Tóm tắt lý thuyết Hóa học 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals ngắn gọn, chi tiết sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học 10.
Lý thuyết Hóa học 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
A. Lý thuyết Liên kết hydrogen và tương tác Van Der Waals
I. Liên kết hydrogen
1. Khái niệm
- Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
- Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
- Liên kết hydrogen thường được kí hiệu là dấu ba chấm (...), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
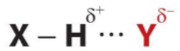
Trong đó, X, Y là các nguyên tử N, O, F
- Liên kết hydrogen có bản chất tĩnh điện. Tương tác hút tĩnh điện giữa và thể hiện bản chất của liên kết hydrogen.
Ví dụ 1: Liên kết hydrogen được tạo ra giữa hai phân tử nước được thể hiện qua hình 12.1.
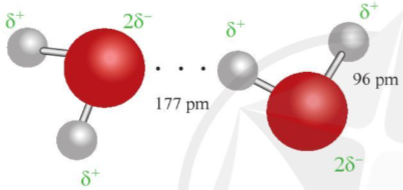
Hình 12.1. Liên kết hydrogen giữa hai phân tử nước
Ở khoảng cách 177 pm, lớn hơn độ dài liên kết cộng hóa trị O – H (96pm), đã xuất hiện liên kết hydrogen.
Lưu ý: Độ dài liên kết là khoảng cách giữa hai hạt nhân của hai nguyên tử tham gia liên kết.
2. Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
a) Đặc điểm tập hợp
- Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử tương đối bền vứng. Kích thước các cụm phân tử này thay đổi tùy theo điều kiện nhiệt độ, áp suất.
® Đây là nguyên nhân dẫn tới các tính chất vật lí khác biệt của nước so với những chất lỏng khác. Do đặc điểm tập hợp đặc biệt này, khi làm lạnh, nước có thể hình thành bông tuyết với nhiều hình dạng khác nhau.
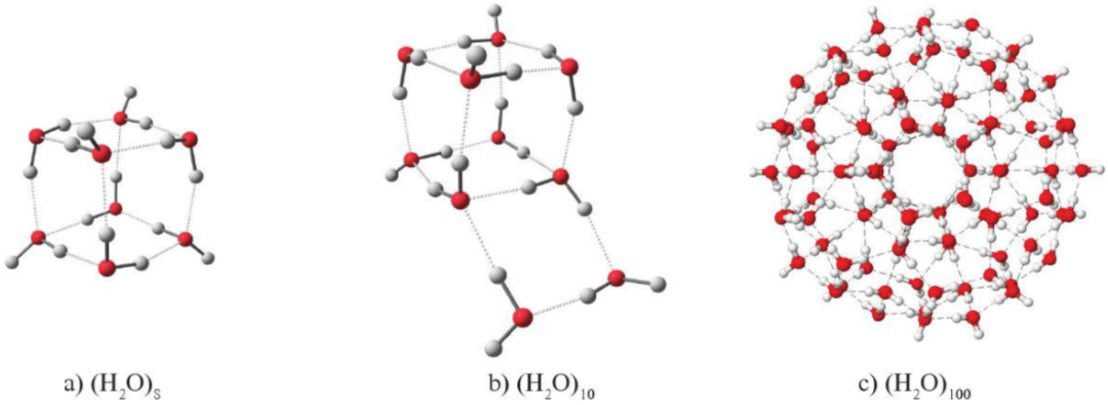
Hình 12.2. Một số cụm phân tử nước
b) Nhiệt độ nóng chảy và nhiệt độ sôi
- Tại áp suất 1atm, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0oC và 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn của nước. Tính chất này là do các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
Bảng 12.1. Nhiệt độ nóng chảy và nhiệt độ sôi của một số chất tại áp suất 1 atm
|
Chất |
Khối lượng phân tử (amu) |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
H2O |
18 |
0 |
100 |
|
H2S |
34 |
-82,3 |
-60,3 |
|
CO2 |
44 |
-57,0 |
-78,0 |
Chú ý: Để một chất có thể nóng chảy hoặc sôi, cần phải cung cấp năng lượng để phá vỡ các liên kết giữa các phân tử và cung cấp động năng để các phân tử chuyển động. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc vào hai yếu tố:
(1) Khối lượng phân tử: Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển động nên nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
(2) Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
II. Tương tác van der Waals
Giữa các phân tử thậm chí không có liên kết hydrogen thì vẫn có tương tác với nhau, mặc dù yếu hơn. Đó là tương tác van der Waals.
1. Khái niệm
- Tương tác van der Waals là một loại liên kết yếu, hình thành do tương tác hút tĩnh điện giữa các cực trái dấu của phân tử.
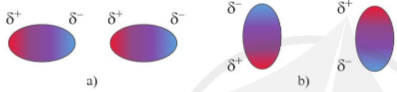
Hình 12.3. Các khả năng tương tác hút tĩnh điện giữa các cực trái dấu của hai phân tử
- Liên kết cộng hóa trị có cực là nguyên nhân dẫn tới sự phân cực ở các phân tử HCl, SO2, ...
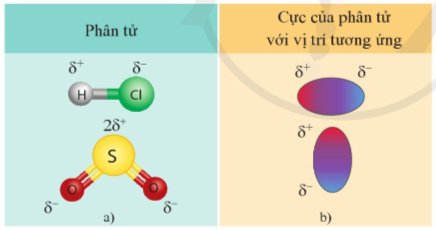
Hình 12.4. Một số phân tử có cực (a) và biểu diễn các cực của phân tử (b)
- Mặc dù có lực liên kết rất yếu, nhưng tương tác van der Waals lại có nhiều ảnh hưởng đến thực tiễn. Ví dụ: sự bám hút của các hạt bụi lên bề mặt nhẵn, sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính, ...
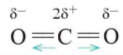
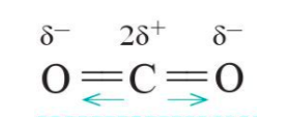
Lưu ý: Phân tử CO2 không có cực, mặc dù liên kết C=O trong phân tử là liên kết có cực. Lí do bởi phân tử này có dạng thẳng, hai liên kết C=O lại có cực ngược chiều nhau nên triệt tiêu lẫn nhau khi xét cho cả phân tử
2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất
- Tương tự như liên kết hydrogen, tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng yếu hơn so với liên kết hydrogen.
B. Trắc nghiệm Liên kết hydrogen và tương tác Van Der Waals
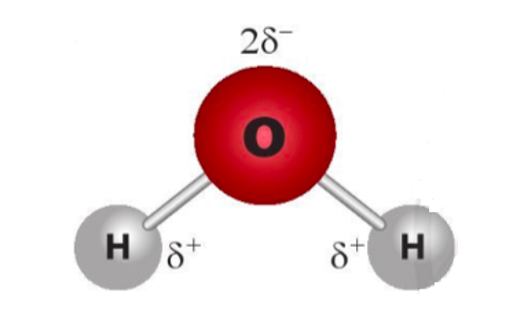
Câu 1. Cho sự phân bố điện tích trong phân tử H2O dưới đây. Liên kết giữa hai phân tử H2O có thể được hình thành qua cặp nguyên tử
A. O với O
B. O với H
C. H với H
D. Cả A, B và C.
Đáp án: B
Giải thích:
Liên kết giữa hai phân tử H2O có thể được hình thành qua nguyên tử H mang điện tích dương của phân tử H2O này với nguyên tử O mang điện tích âm của phân tử nước khác.
Vậy liên kết hình thành qua cặp nguyên tử O với H.
Câu 2. Loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng là
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết hydrogen
Đáp án: D
Giải thích: Liên kết hydrogen là loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
Câu 3. Nguyên tử H trong phân tử H2O không tạo được liên kết hydrogen với
A. nguyên tử N trong phân tử NH3
B. nguyên tử F trong phân tử HF
C. nguyên tử O trong phân tử H2O
D. nguyên tử C trong phân tử CH4
Đáp án: D
Giải thích:
Công thức electron của các phân tử NH3; HCl; HF; CH4 lần lượt là:
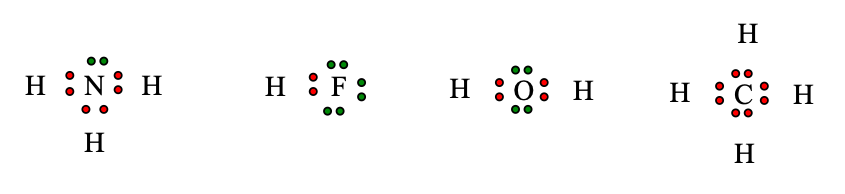
Nguyên tử C trong phân tử CH4 không còn cặp electron hóa trị riêng nên nguyên tử H trong phân tử H2O không tạo được liên kết hydrogen với nguyên tử C trong phân tử CH4.
Câu 4. Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây
A. CH4
B. NH3
C. H3C – O – CH3
D. PH3
Đáp án: B
Giải thích:
CH4: nguyên tử C không có cặp electron hóa trị riêng nên không xuất hiện liên kết hydrogen giữa các phân tử CH4.
NH3: nguyên tử N có cặp electron hóa trị riêng và nguyên tử H liên kết với nguyên tử N có độ âm điện lớn ⇒ xuất hiện liên kết hydrogen giữa các phân tử NH3
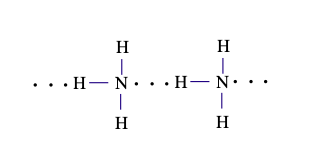
H3C – O – CH3, PH3: nguyên tử H không liên kết với nguyên tử có độ âm điện lớn nên không xuất hiện liên kết hydrogen giữa các phân tử.
Câu 5. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là
A. N
B. O
C. F
D. Cả A, B và C
Đáp án: D
Giải thích: Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Câu 6. Một loại liên kết rất yếu, hình thành bởi tương tác hút tĩnh điện giữa các cự trái dấu của phân tử là
A. tương tác van der waals
B. liên kết hydrogen
C. liên kết ion
D. liên kết cộng hóa trị
Đáp án: A
Giải thích: Tương tác van der waals là một loại liên kết rất yếu, hình thành bởi tương tác hút tĩnh điện giữa các cự trái dấu của phân tử.
Câu 7. Cho các phát biểu sau:
(1) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(2) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(3) Tương tác van der waals yếu hơn liên kết hydrogen.
(4) Tương tác van der waals mạnh hơn liên kết hydrogen.
Những phát biểu đúng là
A. (1) và (3)
B. (1) và (4)
C. (2) và (3)
D. (2) và (4)
Đáp án: A
Giải thích:
Những phát biểu đúng là
(1) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(3) Tương tác van der waals yếu hơn liên kết hydrogen.
Câu 8. Liên kết hydrogen ảnh hưởng tới tính chất của nước như
A. đặc điểm tập hợp
B. nhiệt độ nóng chảy
C. nhiệt độ sôi
D. Cả A, B và C
Đáp án: D
Giải thích: Liên kết hydrogen ảnh hưởng tới tính chất của nước như: đặc điểm tập hợp, nhiệt độ nóng chảy và nhiệt độ sôi.
Câu 9. Nguyên nhân dẫn tới sự phân cực của các phân tử HCl, SO2, … là do
A. liên kết ion
B. liên kết cộng hóa trị không cực
C. liên kết cộng hóa trị có cực
D. liên kết hydrogen
Đáp án: C
Giải thích:
Nguyên nhân dẫn tới sự phân cực của các phân tử HCl, SO2, … là do liên kết cộng hóa trị có cực.
Câu 10. Phân tử nào dưới đây không có cực
A. HCl
B. CO2
C. H2O
D. NH3
Đáp án: B
Giải thích:
Liên kết C = O trong phân tử CO2 là liên kết có cực. Tuy nhiên phân tử CO2 có cấu tạo thẳng, hai liên kết C = O lại có cực ngược chiều nhau nên triệt tiêu lẫn nhau khi xét cho cả phân tử. Do đó phân tử CO2 không có cực.
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Cánh diều hay, chi tiết khác:
Lý thuyết Bài 13: Phản ứng oxi hóa – khử
Lý thuyết Bài 14: Phản ứng hóa học và enthalpy
Lý thuyết Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều
