Lý thuyết Hóa học 10 Bài 9 (Cánh diều): Quy tắc octet
Tóm tắt lý thuyết Hóa học 10 Bài 9: Quy tắc octet ngắn gọn, chi tiết sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học 10.
Lý thuyết Hóa học 10 Bài 9: Quy tắc octet
A. Lý thuyết Quy tắc octet
I. Quy tắc octet
Quy tắc octet lần đầu được đưa ra bởi Lewis (nhà hóa học, vật lí người Mỹ) để lí giải xu hướng các nguyên tử trở nên bền vững hơn trong phản ứng hóa học.
- Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm.
- Các nguyên tử khí hiếm bền vững hơn rất nhiều so với các nguyên tử nguyên tố khác trong cùng chu kì nên rất khó tham gia các phản ứng hóa học. Điều này là do chúng có lớp electron ngoài cùng đã bão hòa với 8 electron (trừ He với 2 electron).
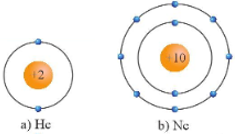
Hình 9.1. Mô hình cấu tạo nguyên tử của He và Ne
- Các nguyên tử liên kết với nhau theo xu hướng chung là tạo ra lớp electron ngoài cùng như của khí hiếm gần nhất để mỗi nguyên tử đó trở nên bền vững hơn.
II. Vận dụng quy tắc octet trong quá trình hình thành liên kết hóa học của các nguyên tố nhóm A
- Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình electron bền vững như của khí hiếm gần nhất với 8 electron ở lớp ngoài cùng (hoặc có 2 electron ở lớp ngoài cùng như của He).
Ví dụ 1: O (Z = 8) có cấu hình electron là 1s22s22p4
Oxygen có 6 electron lớp ngoài cùng. Vậy xu hướng cơ bản của nguyên tử oxygen khi hình thành liên kết hóa học là nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ar.
Sơ đồ nguyên tử O nhận thêm 2 electron vào lớp ngoài cùng:
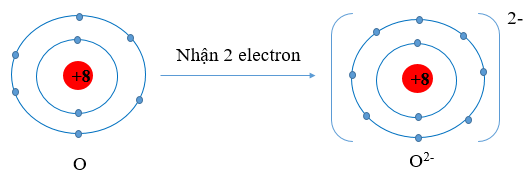 Hình 9.2. Sơ đồ nguyên tử oxygen nhận thêm 2 electron vào lớp ngoài cùng
Hình 9.2. Sơ đồ nguyên tử oxygen nhận thêm 2 electron vào lớp ngoài cùng
Ví dụ 2: K (Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1. Vậy K có 1 electron lớp vỏ ngoài cùng. Nguyên tử K có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là K+.
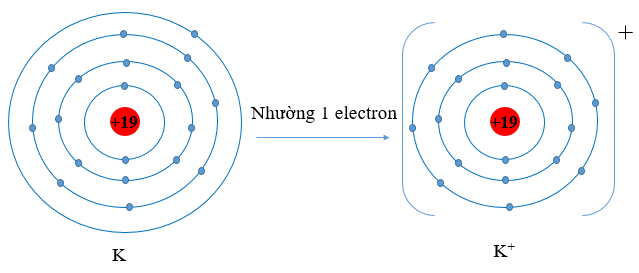
Hình 9.3. Sơ đồ nguyên tử potassium nhường đi 1 electron vào lớp ngoài cùng
Ví dụ 3: Nguyên tử N (Z = 7) có cấu hình electron là 1s22s22p3
Nguyên tử H (Z = 1) có cấu hình electron là 1s1
Để đạt được cấu hình của khí hiếm gần nhất, nguyên tử N cần thêm 3 electron, nguyên tử H cần thêm 1 electron. Vì vậy mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử N để tạo thành 3 cặp electron chung.
Các cặp electron chung cho phân tử NH3
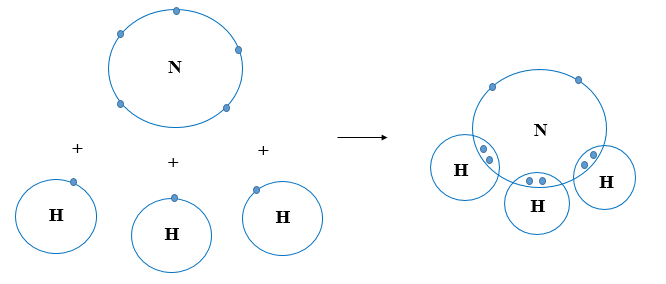
Hình 9.4. Sơ đồ góp chung electron của các nguyên tử trong phân tử NH3
Nhận xét:
- Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường bớt toàn bộ các electron này để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng.
- Trong cùng chu kì, nguyên tử có 1 electron ở lớp ngoài cùng (các kim loại kiềm) dễ nhường electron hơn nên có tính kim loại mạnh nhất.
- Ngoài cách các nguyên tử nhường và nhận electron để hình thành liên kết ion, quy tắc octet có thể đạt được bằng cách góp chung electron.
Lưu ý: Quy tắc octet có một số ngoại lệ như: SF6 (lớp vỏ ngoài cùng của S có 12 electron); PCl5 (lớp vỏ ngoài cùng của S có 10 electron), ...
B. Trắc nghiệm Quy tắc octet
Câu 1. Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như
A. kim loại;
B. phi kim;
C. helium;
D. khí hiếm.
Đáp án: D
Giải thích: Theo quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như khí hiếm (helium, neon, argon, …)
Câu 2. Lớp electron ngoài cùng bão hòa với
A. 10 electron;
B. 8 electron;
C. 2 electron;
D. 8 electron (trừ He với lớp electron ngoài cùng bão hòa với 2 electron).
Đáp án: D
Giải thích: Lớp electron ngoài cùng bão hòa với 8 electron (trừ He với lớp electron ngoài cùng bão hòa với 2 electron).
Câu 3. Nguyên tử có lớp electron ngoài cùng bền vững là
A. Na (Z = 11)
B. Cl (Z = 17)
C. Ne (Z = 10)
D. O (Z = 8)
Đáp án: C
Giải thích:
Lớp electron ngoài cùng bền vững khi bão hòa với 8 electron (trừ He với lớp electron ngoài cùng bão hòa với 2 electron).
Na (Z = 11) có cấu hình electron: 1s22s22p63s1⇒ có 1 electron lớp ngoài cùng.
Cl (Z = 17) có cấu hình electron: 1s22s22p63s23p5⇒ có 7 electron lớp ngoài cùng.
Ne (Z = 10) có cấu hình electron: 1s22s22p6⇒ có 8 electron lớp ngoài cùng.
O (Z = 8) có cấu hình electron: 1s22s22p4⇒ có 6 electron lớp ngoài cùng.
Vậy Ne có 8 electron lớp ngoài cùng. Do đó Ne có lớp electron ngoài cùng bền vững.
Câu 4. Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng ………….. để đạt được cấu hình electron bền vững như của khí hiếm gần nhất với 8 electron lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như của helium).
Cụm từ thích hợp điền vào chỗ chấm trên là
A. nhường electron
B. nhận electron
C. góp chung electron
D. nhường, nhận hoặc góp chung electron
Đáp án: D
Giải thích: Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình electron bền vững như của khí hiếm gần nhất với 8 electron lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như của helium).
Câu 5. Các phi kim với 5, 6 hoặc 7 electron lớp ngoài cùng có xu hướng
A. nhường 5, 6 hoặc 7 electron lớp ngoài cùng để tạo thành ion dương
B. nhường 5, 6 hoặc 7 electron lớp ngoài cùng để tạo thành ion âm
C. nhận 3, 2 hoặc 1 electron lớp ngoài cùng để tạo thành ion dương
D. nhận 3, 2 hoặc 1 electron lớp ngoài cùng để tạo thành ion âm
Đáp án: D
Giải thích: Các phi kim với 5, 6 hoặc 7 electron lớp ngoài cùng có xu hướng nhận 3, 2 hoặc 1 electron lớp ngoài cùng để tạo thành ion âm tương ứng có 8 electron lớp ngoài cùng.
Câu 6. Các kim loại có 1, 2 hoặc 3 electron lớp ngoài cùng có xu hướng
A. nhường 1, 2 hoặc 3 electron lớp ngoài cùng để tạo thành ion dương
B. nhường 1, 2 hoặc 3 electron lớp ngoài cùng để tạo thành ion âm
C. nhận 7, 6 hoặc 5 electron lớp ngoài cùng để tạo thành ion dương
D. nhận 7, 6 hoặc 5 electron lớp ngoài cùng để tạo thành ion âm
Đáp án: A
Giải thích: Các kim loại có 1, 2 hoặc 3 electron lớp ngoài cùng có xu hướng nhường 1, 2 hoặc 3 electron lớp ngoài cùng để tạo thành ion dương tương ứng có 8 electron lớp ngoài cùng.
Câu 7. Nguyên tử nitrogen và nguyên tử nhôm có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình electron bền vững?
A. Nhận 3 electron, nhường 3 electron
B. Nhận 5 electron, nhường 5 electron
C. Nhường 3 electron, nhận 3 electron
D. Nhường 5 electron, nhận 5 electron
Đáp án: A
Giải thích:
Nitrogen (Z = 7) có cấu hình electron: 1s22s22p3⇒ là phi kim với 5 electron lớp ngoài cùng ⇒ có xu hướng nhận 3 electron để đạt được cấu hình electron bền vững.
Nhôm (Z = 13) có cấu hình electron: 1s22s22p63s23p1⇒ là kim loại với 3 electron lớp ngoài cùng ⇒ có xu hướng nhường 3 electron để đạt được cấu hình electron bền vững.
Câu 8. Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học?
A. Helium
B. Fluorine
C. Aluminium
D. Sodium
Đáp án: D
Giải thích:
Helium (Z = 2) có cấu hình electron: 1s2 ⇒ là khí hiếm với 2 electron lớp ngoài cùng ⇒ đây là cấu hình electron bền vững nên không có xu hướng nhường hoặc nhận electron.
Fluorine (Z = 9) có cấu hình electron: 1s22s22p5 ⇒ là phi kim với 7 electron lớp ngoài cùng ⇒ có xu hướng nhận 1 electron để đạt được cấu hình electron bền vững.
Aluminium (Z = 13) có cấu hình electron: 1s22s22p63s23p1⇒ là kim loại với 3 electron lớp ngoài cùng ⇒ có xu hướng nhường 3 electron để đạt được cấu hình electron bền vững.
Sodium (Z = 11) có cấu hình electron: 1s22s22p63s1⇒ là kim loại với 1 electron lớp ngoài cùng ⇒ có xu hướng nhường 1 electron để đạt được cấu hình electron bền vững.
Câu 9. Nguyên tử nguyên tố nào sau đây có xu hướng nhận thêm 2 electron khi hình thành liên kết hóa học?
A. Oxide
B. Neon
C. Carbon
D. Magnesium
Đáp án: A
Giải thích:
Oxide (Z = 8) có cấu hình electron: 1s22s22p4⇒ là phi kim với 6 electron lớp ngoài cùng ⇒ có xu hướng nhận 2 electron để đạt được cấu hình electron bền vững.
Neon (Z = 10) có cấu hình electron: 1s22s22p6⇒ là khí hiếm với 8 electron lớp ngoài cùng ⇒ đây là cấu hình electron bền vững nên không có xu hướng nhường hoặc nhận electron.
Carbon (Z = 6) có cấu hình electron: 1s22s22p2⇒ là phi kim với 4 electron lớp ngoài cùng ⇒ có xu hướng nhận 4 electron để đạt được cấu hình electron bền vững.
Magnesium (Z = 12) có cấu hình electron: 1s22s22p63s2⇒ là kim loại với 2 electron lớp ngoài cùng ⇒ có xu hướng nhường 2 electron để đạt được cấu hình electron bền vững.
Câu 10. Xu hướng tạo lớp vỏ bền vững hơn của nguyên tử thể hiện như thế nào khi kim loại điểm hình tác dụng với phi kim điển hình
A. Kim loại nhường electron để phi kim nhận để cả kim loại và phi kim cùng đạt cấu hình electron bền vững.
B. Kim loại nhận electron của phi kim nhường để cả kim loại và phi kim cùng đạt cấu hình electron bền vững.
C. Kim loại và phi kim cùng góp chung electron để cả kim loại và phi kim cùng đạt cấu hình electron bền vững.
D. Kim loại và phi kim cùng nhường electron để cả kim loại và phi kim cùng đạt cấu hình electron bền vững.
Đáp án: A
Giải thích:
Kim loại có xu hướng nhường electron, phi kim có xu hướng nhận electron.
⇒ Kim loại nhường electron, phi kim nhận electron từ nguyên tử kim loại để cả kim loại và phi kim cùng đạt cấu hình electron bền vững.
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Cánh diều hay, chi tiết khác:
Lý thuyết Bài 10: Liên kết ion
Lý thuyết Bài 11: Liên kết cộng hóa trị
Lý thuyết Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều
