Giải SBT Khoa học tự nhiên 7 trang 11 Cánh diều
Với Giải SBT Khoa học tự nhiên 7 trang 11 trong Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học Sách bài tập KHTN lớp 7 Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập trong SBT KHTN 7 trang 11.
Giải SBT Khoa học tự nhiên 7 trang 11 Cánh diều
Bài 3.6 trang 11 SBT Khoa học tự nhiên 7: Cho biết một nguyên tử của nguyên tố X có điện tích hạt nhân là +17. Hãy chọn câu đúng trong các câu sau:
A. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
B. Nguyên tố X ở chu kì 3, nhóm VIIA; là phi kim; có 17 proton, 17 electron.
C. Nguyên tố X ở chu kì 2, nhóm VIIA; là kim loại; có 17 proton, 17 electron.
D. Nguyên tố X ở chu kì 2, nhóm VIIA; là phi kim; có 17 proton, 7 electron.
Lời giải:
Đáp án đúng là: B
- X có điện tích hạt nhân là +17 nên nguyên tử X có 17 proton và 17 electron (loại đáp án A và D).
- X có 17 electron được phân vào 3 lớp, vậy X thuộc chu kì 3 (loại đáp án C).
Bài 3.7 trang 11 SBT Khoa học tự nhiên 7: Quan sát mô hình cấu tạo của bốn nguyên tử thuộc bốn nguyên tố có kí hiệu lần lượt là A1, A2, A3, A4 dưới đây:
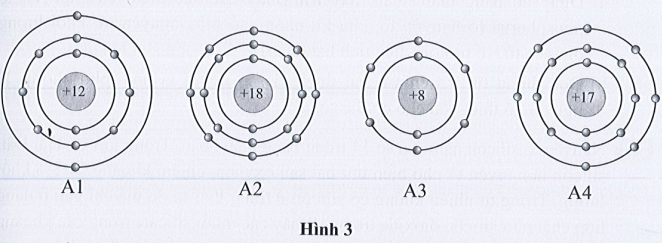
Điền các thông tin còn thiếu vào bảng sau đây:
|
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
|
Số lớp electron |
|
|
|
|
|
Số electron lớp ngoài cùng |
|
|
|
|
|
Số hiệu nguyên tử |
|
|
|
|
|
Số proton |
|
|
|
|
Lời giải:
Chú ý: Trong nguyên tử:
Số hiệu nguyên tử = số proton = số electron.
|
Nguyên tử nguyên tố |
A1 |
A2 |
A3 |
A4 |
|
Số lớp electron |
3 |
3 |
2 |
3 |
|
Số electron lớp ngoài cùng |
2 |
8 |
6 |
7 |
|
Số hiệu nguyên tử |
12 |
18 |
8 |
17 |
|
Số proton |
12 |
18 |
8 |
17 |
Bài 3.8 trang 11 SBT Khoa học tự nhiên 7: Quan sát bảng tuần hoàn các nguyên tố hóa học và cho biết:
a) Một số thông tin (ô nguyên tố, chu kì, nhóm; là nguyên tố kim loại, phi kim hay khí hiếm) của những nguyên tố có số thứ tự lần lượt là 6, 9 và 19.
b) Vì sao các nguyên tố Li, Na và K được xếp vào cùng một cột/ nhóm? Giải thích tương tự với các nguyên tố O, S và Se.
c) Vì sao các nguyên tố B, C, N, O và F được xếp vào cùng một hàng/ chu kì? Giải thích tương tự với các nguyên tố Na, Mg và Al.
d) Vì sao các nguyên tố He, Ne và Ar được xếp vào cùng một cột/ nhóm?
Lời giải:
a) Một số thông tin (ô nguyên tố, chu kì, nhóm; là nguyên tố kim loại, phi kim hay khí hiếm) của những nguyên tố có số thứ tự lần lượt là 6, 9 và 19 được thể hiện trong bảng sau:
|
Ô nguyên tố |
Tên nguyên tố |
Kí hiệu hóa học |
Số proton |
KLNT |
Số electron |
Chu kì |
Nhóm |
Loại nguyên tố |
|
6 |
Carbon |
C |
6 |
12 |
6 |
2 |
IVA |
Phi kim |
|
9 |
Fluorine |
F |
9 |
19 |
9 |
2 |
VIIA |
Phi kim |
|
19 |
Potassium |
K |
19 |
39 |
19 |
4 |
IA |
Kim loại |
b)
- Các nguyên tố Li, Na và K được xếp vào cùng một cột (cùng nhóm IA) vì cả 3 nguyên tố này đều có 1 electron ở lớp ngoài cùng.
- Tương tự, các nguyên tố O, S và Se được xếp vào cùng một cột (nhóm VIA) vì cả 3 nguyên tố đều có 6 electron ở lớp ngoài cùng.
c)
- Các nguyên tố B, C, O và F được xếp vào cùng 1 hàng (chu kì 2) vì cả 5 nguyên tố này đều có 2 lớp electron trong nguyên tử.
- Tương tự, các nguyên tố Na, Mg và Al được xếp vào cùng 1 hàng (chu kì 3) vì nguyên tử của các nguyên tố này đều có 3 lớp electron.
d)
Các nguyên tố He, Ne và Ar đều được xếp vào cùng một cột (nhóm VIIIA) vì cả hai nguyên tố Ne và Ar đều có 8 electron ở lớp ngoài cùng, còn nguyên tố He (đặc biệt) chỉ có 2 electron ở lớp ngoài cùng.
Số electron lớp ngoài cùng là 8 (riêng với He là 2) là cấu trúc bền vững và nhóm này còn có tên gọi là các nguyên tố khí hiếm.
Xem thêm lời giải sách bài tập Khoa học tự nhiên lớp 7 Cánh diều với cuộc sống hay, chi tiết khác:
Giải SBT Khoa học tự nhiên 7 trang 9
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Cánh Diều
- Giải sbt Toán 7 – Cánh Diều
- Lý thuyết Toán 7 – Cánh Diều
- Giải VBT Toán 7 – Cánh diều
- Soạn văn lớp 7 (hay nhất)– Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Giải sbt Ngữ văn lớp 7 – Cánh Diều
- Văn mẫu lớp 7 – Cánh Diều
- Soạn văn lớp 7 (ngắn nhất) – Cánh Diều
- Giải VBT Ngữ văn lớp 7 – Cánh diều
- Giải sgk Tiếng Anh 7 - Explore English
- Giải sgk Tiếng Anh 7 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 7 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 7 i-learn Smart World
- Bài tập Tiếng Anh 7 iLearn Smart World theo Unit có đáp án
- Giải sbt Tiếng Anh 7 - ilearn Smart World
- Giải sgk Lịch sử 7 – Cánh Diều
- Lý thuyết Lịch Sử 7 – Cánh Diều
- Giải sbt Lịch sử 7 – Cánh Diều
- Giải VBT Lịch sử 7 – Cánh diều
- Giải sgk Địa lí 7 – Cánh Diều
- Lý thuyết Địa Lí 7 – Cánh Diều
- Giải sbt Địa lí 7 – Cánh Diều
- Giải VBT Địa lí 7 – Cánh diều
- Giải sgk Tin học 7 – Cánh Diều
- Lý thuyết Tin học 7 – Cánh Diều
- Giải sbt Tin học 7 – Cánh Diều
- Giải sgk Giáo dục công dân 7 – Cánh Diều
- Lý thuyết Giáo dục công dân 7 – Cánh Diều
- Giải sbt Giáo dục công dân 7 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sgk Công nghệ 7 – Cánh Diều
- Lý thuyết Công nghệ 7 – Cánh Diều
- Giải sbt Công nghệ 7 – Cánh Diều
- Giải sgk Giáo dục thể chất 7 – Cánh Diều
- Giải sgk Âm nhạc 7 – Cánh Diều
