Sách bài tập KHTN 8 Bài 3 (Kết nối tri thức): Mol và tỉ khối chất khí
Với giải sách bài tập Khoa học tự nhiên 8 Bài 3: Mol và tỉ khối chất khí sách Kết nối tri thức hay nhất, ngắn gọn sẽ giúp học sinh dễ dàng làm bài tập trong SBT KHTN 8 Bài 3.
Giải SBT KHTN 8 Bài 3: Mol và tỉ khối chất khí
b) 1,505.1024 phân tử SO2.
c) 7,224.1023 nguyên tử Na.
d) 1,204.1021 phân tử K2O.
Lời giải:
a) Số mol nguyên tử K là: 8,428.10226,022.1023=0,14(mol)
b) Số mol phân tử SO2 là: 1,505.10246,022.1023=2,5(mol)
c) Số mol nguyên tử Na là: 7,224.10236,022.1023=1,2(mol)
d) Số mol phân tử K2O là: 1,204.10216,022.1023=0,002(mol)
Bài 3.2 trang 8 Sách bài tập KHTN 8: Tính số nguyên tử hoặc phân tử có trong những lượng chất sau:
b) 1,15 mol nguyên tử C.
c) 0,05 mol phân tử O2.
d) 2 mol phân tử NO2.
Lời giải:
a) 0,1.6,022.1023 = 6,02.1022 nguyên tử O.
b) 1,15.6,022.1023 = 6,93.1023 nguyên tử C.
c) 0,05.6,022.1023 = 3,11.1022 phân tử O2.
d) 2.6,022.1023 = 1,204.1024 phân tử NO2.
Bài 3.3 trang 8 Sách bài tập KHTN 8: Tính khối lượng của 1 mol
c) phân tử chlorine Cl2.
Lời giải:
a) Khối lượng mol của nguyên tử H: 1 g/mol.
b) Khối lượng mol của nguyên tử Cl: 35,5 g/mol.
c) Khối lượng mol của phân tử Cl2: 35,5.2 = 71 g/mol.
Bài 3.4 trang 8 Sách bài tập KHTN 8: Tính khối lượng (theo đơn vị gam) của những lượng chất sau:
b) 1,12 mol SO2.
c) Hỗn hợp gồm 0,1 mol NaCl và 0,2 mol đường (C12H22O11).
d) Dung dịch có 1 mol C2H5OH và 2 mol nước (H2O).
Lời giải:
a) Khối lượng sắt là: mFe = 0,15.56 = 8,4 (g).
b) Khối lượng mol phân tử SO2 là: 32 + 16.2 = 64 (g/mol).
Khối lượng SO2 là: mSO2= 1,12.64 = 71,68 (g).
c) Khối lượng mol phân tử NaCl là: 23 + 35,5 = 58,5 (g/mol)
Khối lượng NaCl là: mNaCl = 58,5.0,1 = 5,85 (g);
Khối lượng mol phân tử đường là: 12.12 + 22.1 + 11.16 = 342 (g/mol)
Khối lượng đường là: mđường = 0,2.342 = 68,4 (g).
Khối lượng hỗn hợp: 5,85 + 68,4 = 74,25 (g).
d) Khối lượng mol phân tử C2H5OH là: 2.12 + 6.1 + 16 = 46 (g/mol)
Khối lượng C2H5OH là: mC2H5OH= 1.46 = 46 (g);
Khối lượng mol phân tử nước là: 2.1 + 16 = 18 (g/mol)
Khối lượng nước là: mnước = 2.18 = 36 (g)
Khối lượng dung dịch là: 46 + 36 = 82 (g).
Bài 3.5 trang 9 Sách bài tập KHTN 8: Lượng chất nào sau đây chứa số mol nhiều nhất?
B. 8 gam SO2.
C. 16 gam CuSO4.
D. 32 gam Fe2O3.
Lời giải:
Đáp án đúng là: A
|
Chất |
O2 |
SO2 |
CuSO4 |
Fe2O3 |
|
Khối lượng |
16 |
8 |
16 |
32 |
|
Số mol tính được |
0,5 |
0,125 |
0,1 |
0,2 |
Bài 3.6 trang 9 Sách bài tập KHTN 8: Hãy tính:
a) Số mol nguyên tử Cl có trong 36,5 gam hydrochloric acid (HCl).
b) Số mol nguyên tử O có trong 11 gam khí carbon dioxide (CO2).
c) Số mol nguyên tử C có trong 3,42 gam đường (C12H22O11).
Lời giải:
a) Số mol phân tử HCl: = 1 (mol)
Trong 1 phân tử HCl có 1 nguyên tử Cl.
Vậy: 1 mol phân tử HCl có 1 mol nguyên tử Cl.
b) Số mol phân tử CO2 là: = 0,25 (mol)
Trong 1 phân tử CO2 có hai nguyên tử O.
Vậy: 0,25 mol phân tử CO2 có 0,5 mol nguyên tử O.
c) Số mol phân tửC12H22O11: = 0,01 (mol)
Trong 1 phân tử C12H22O11 có 11 nguyên tử C.
Vậy: 0,01 mol phân tử C12H22O11 có 0,11 mol nguyên tử C.
Bài 3.7 trang 9 Sách bài tập KHTN 8: Tìm thể tích ở 25 °C, 1 bar của những lượng khí sau:
c) 3,01.1022 phân tử H2.
Lời giải:
a) VCH4 = 24,79.1,5 = 37,185 (L).
b) Số mol N2 là: nN2=4228= 1,5 (mol)
VN2 = 24,79.1,5 = 37,185 (L).
c) Số mol H2 là: nH2=3,01.10226,022.1023= 0,05 (mol)
VH2 = 24,79.0,05 = 1,2395 (L).
Bài 3.8 trang 9 Sách bài tập KHTN 8: Tìm thể tích ở 25 °C, 1 bar của những lượng khí sau:
a) Hỗn hợp gồm 1 mol CO2 và 1 mol O2.
b) Hỗn hợp gồm 0,05 mol CO; 0,15 mol CO2 và 0,2 mol O2.
c) Hỗn hợp gổm 10 gam O2 và 14 gam N2.
Lời giải:
a) Tổng số mol khí là: 1 + 1 = 2 (mol).
Thể tích hỗn hợp là: Vhỗn hợp = 24,79.2 = 49,58 (L).
b) Tổng số mol khí là: 0,05 + 0,15 + 0,2 = 0,4 (mol).
Thể tích hỗn hợp là: Vhỗn hợp = 24,79.0,4 = 9,916 (L).
c) Số mol O2: nO2=1032= 0,3125 (mol).
Số mol N2: nN2=1428= 0,5 (mol).
Tổng số mol khí: 0,3125 + 0,5 = 0,8125 (mol).
Thể tích hỗn hợp: Vhỗn hợp = 24,79.0,8125 = 20,142 (L).
Lời giải:
Số mol khí CO2 trong quả bóng là:
nCO2=224,79= 0,081 (mol)
Khối lượng khí carbon dioxide trong quả bóng là:
mCO2= 0,081.44 = 3,564 (g).
Lời giải:
Áp dụng công thức: dA/kk=MA29, ta có:
dHCl/kk=36,529=1,259;
dNH3/kk=1729=0,586;
dC2H6/kk=3029=1,034;
dH2S/kk=3429=1,172;
dNO/kk=3029=1,034;
dNO2/kk=4629=1,586.
Bài 3.11 trang 9 Sách bài tập KHTN 8: Trong các câu sau đây, câu nào đúng, câu nào sai?
tử Cl2 có 0,06 mol nguyên tử Cl.
b) Số nguyên tử O trong 0,15 mol phân tử O2 và trong 0,1 mol phân tử O3 bằng nhau.
c) Ở cùng điều kiện nhiệt độ và áp suất, thể tích của 0,1 mol khí H2 bằng thể tích của hỗn hợp gồm 1 mol khí HCl và 0,1 mol khí HBr.
Lời giải:
a) Sai vì 0,12 mol phân tử Cl2 có 0,24 mol nguyên tử Cl.
b) Đúng vì số mol nguyên tử O trong 0,15 mol phân tử O2 là 0,3 mol; số mol nguyên tử O trong 0,1 mol phân tử O3 cũng là 0,3 mol.
c) Sai vì ở cùng điều kiện nhiệt độ và áp suất, thể tích của 0,1 mol khí H2 nhỏ hơn thể tích của hỗn hợp gồm 1 mol khí HCl và 0,1 mol khí HBr.
Lời giải:
Ở cùng điều kiện nhiệt độ, áp suất, số mol khí trong 4 quả bóng giống hệt nhau sẽ bằng nhau. Như vậy, khối lượng khí sẽ tỉ lệ thuận với khối lượng phân tử của các khí.
Vậy, khối lượng khí trong các quả bóng giảm dần như sau: H2 < He < CO2 < Cl2.
Hay khối lượng khí trong quả bóng chứa Cl2 là lớn nhất; khối lượng khí trong quả bóng chứa H2 là bé (nhỏ) nhất.
Acetylene (C2H2); oxygen (O2); hydrogen (H2); carbon dioxide (CO2); sunfur dioxide (SO2).
Hãy giải thích.
Lời giải:
|
Khí |
C2H2 |
O2 |
H2 |
CO2 |
SO2 |
|
KLPT |
26 |
32 |
2 |
44 |
64 |
Quả bóng bị đẩy lên trên chứng tỏ khí trong quả bóng nhẹ hơn không khí, tức là khối lượng mol phân tử của khí đó nhỏ hơn 29 g/mol.
Các khí có thể chứa trong quả bóng đó: acetylene (C2H2) M = 26 g/mol, hydrogen (H2) M = 2 g/mol.
Bài 3.14* trang 10 Sách bài tập KHTN 8: Tính khối lượng mol trung bình của các hỗn hợp khí sau đây:
a) Hỗn hợp gồm H2 và Cl2 có tỉ lệ 1 : 1 về số mol.
b) Hỗn hợp gồm CO và N2 có tỉ lệ 2 : 3 về số mol.
c) Hỗn hợp gồm H2, CO2 và N2 có tỉ lệ 1 :2 :1 về số mol.
Cho biết công thức tính khối lượng mol phân tử trung bình của một hỗn hợp:
MTB=mhhnhh=M1.n1+M2.n2+....n1+n2+....
Trong đó:
MTB là khối lượng mol phân tử trung bình của hỗn hợp.
M1, M2... là khối lượng mol của các chất trong hỗn hợp.
n1, n2,... là số mol tương ứng của các chất.
Lời giải:
a) Khối lượng mol trung bình của hỗn hợp:
MTB=2.1+71.11+1 = 36,5 (g/mol);
b) Khối lượng mol trung bình của hỗn hợp:
MTB=28.2+28.32+3 = 28 (g/mol);
c) Khối lượng mol trung bình của hỗn hợp:
MTB=2.1+44.2+28.11+2+1= 29,5 (g/mol);
Lời giải:
Hỗn hợp (a), (c) nặng hơn không khí; hỗn hợp (b) nhẹ hơn không khí.
Tỉ khối của các hỗn hợp so với không khí:
dhh(a)/kk=36,529=1,259;dhh(b)/kk=2829=0,966;dhh(c)/kk=29,529=1,017.
Lời giải:
Khối lượng ethanol cần lấy: methanol = 1,56.46 = 71,76 gam.
Thể tích ethanol cần lấy: Vethanol = mD=71,760,78=92(mL).
Vậy: dùng ống đong lấy 92 mL ethanol, đó là 1,56 mol ethanol.
Lời giải:
Thể tích không khí trong lớp học: 10 . 6 . 3,5 = 210 (m3).
Thể tích oxygen: 210.20% = 42 (m3) = 42 000 L.
Số mol oxygen: 4200024,79= 1694 (mol).
Khối lượng oxygen: moxygen = 1694 . 32 = 54 208 (g).
Thể tích nitrogen: 210.80% = 168 (m3) = 168 000 L.
Số mol nitrogen: 16800024,79= 6777 (mol).
Khối lượng nitrogen: mnitrogen = 6777.28 = 189756(g).
Khối lượng không khí trong lớp học:
mkk = 54 208 + 189 756 = 243 946 (g) = 243,946 kg.
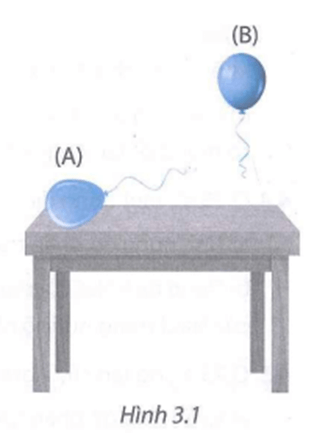
Bài 3.18 trang 10 Sách bài tập KHTN 8: a) Có hai hỗn hợp khí như sau:
(1) Hỗn hợp CO và C2H6 có tỉ lệ 1 : 2 về số mol.
(2) Hỗn hợp CH4 và CO2 có tỉ lệ 2 : 1 về số mol.
Bơm các hỗn hợp khí trên vào quả bóng A và B giống hệt nhau. Quan sát thấy hiện tượng như Hình 3.1.
a) Quả bóng A và B lần lượt chứa hỗn hợp khí nào?
b) Nếu một quả bóng được bơm đầỵ bằng không khí, nó sẽ bị đẩy bay lên hay nằm trên mặt bàn?
Lời giải:
a) Khối lượng mol phân tử trung bình của hỗn hợp 1:
Mhh(1)=28.1+30.21+2= 29,333 (g/mol)
Khối lượng mol phân tử trung bình của hỗn hợp 2:
Mhh(2)=16.2+44.12+1= 25,333 (g/mol).
Quả bóng B bay lên nên suy ra sẽ chứa hỗn hợp khí có khối lượng mol phân tử trung bình nhỏ hơn không khí. Vậy B chứa hỗn hợp (2).
Còn lại quả bóng A chứa khí nặng hơn không khí, không bay lên được. Vậy A chứa hỗn hợp (1).
b) Nếu một quả bóng được bơm đầy bằng không khí, nó sẽ nằm trên mặt bàn.
Lời giải:
Ở cùng điều kiện nhiệt độ và áp suất, nếu 2 khí có cùng thể tích thì có cùng số mol.
Số mol khí nitrogen là: nN2=1428= 0,5 (mol)
Vậy số mol ethanol cũng là 0,5 mol.
Suy ra khối lượng ethanol là: m = 46.0,5 = 23 (gam).
Xem thêm lời giải Sách bài tập Khoa học tự nhiên 8 sách Kết nối tri thức hay, chi tiết khác:
Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Bài 6: Tính theo phương trình hóa học
Xem thêm các chương trình khác:
- Soạn văn 8 Kết nối tri thức (hay nhất)
- Văn mẫu lớp 8 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 8 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn lớp 8 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 8 - Kết nối tri thức
- Giải SBT Ngữ văn 8 – Kết nối tri thức
- Giải Vở thực hành Ngữ văn 8 Kết nối tri thức | VTH Ngữ văn 8 Tập 1, Tập 2
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Kết nối tri thức
- Soạn văn 8 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 8 – Kết nối tri thức
- Lý thuyết Toán 8 – Kết nối tri thức
- Giải sbt Toán 8 – Kết nối tri thức
- Vở thực hành Toán 8 Kết nối tri thức | Giải VTH Toán 8 Tập 1, Tập 2
- Chuyên đề dạy thêm Toán 8 cả 3 sách (2024 có đáp án)
- Bài tập Tiếng Anh 8 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 8 – Global success
- Giải sbt Tiếng Anh 8 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 8 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 8 Global success
- Giải sgk Lịch sử 8 – Kết nối tri thức
- Lý thuyết Lịch sử 8 - Kết nối tri thức
- Giải sbt Lịch sử 8 – Kết nối tri thức
- Giải sgk Địa lí 8 – Kết nối tri thức
- Lý thuyết Địa lí 8 - Kết nối tri thức
- Giải sbt Địa lí 8 – Kết nối tri thức
- Giải VTH Địa lí 8 Kết nối tri thức | Vở thực hành Địa lí 8
- Giải sgk Giáo dục công dân 8 – Kết nối tri thức
- Lý thuyết Giáo dục công dân 8 – Kết nối tri thức
- Giải sbt Giáo dục công dân 8 – Kết nối tri thức
- Giải sgk Công nghệ 8 – Kết nối tri thức
- Lý thuyết Công nghệ 8 - Kết nối tri thức
- Giải sbt Công nghệ 8 – Kết nối tri thức
- Giải sgk Tin học 8 – Kết nối tri thức
- Lý thuyết Tin học 8 - Kết nối tri thức
- Giải sbt Tin học 8 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 8 – Kết nối tri thức