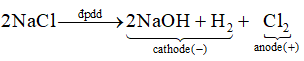Sách bài tập Hóa 12 Bài 12 (Cánh diều): Điện phân
Với giải sách bài tập Hóa 12 Bài 12: Điện phân sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa 12 Bài 12.
Giải SBT Hóa 12 Bài 12: Điện phân
Bài 12.1 trang 41 Sách bài tập Hóa học 12: Điền từ hoặc cụm từ thích hợp vào chỗ trống trong các câu sau:
a) Điện phân là quá trình ...(1)... xảy ra trên bề mặt các điện cực dưới tác dụng của ...(2)... đi qua dung dịch chất điện li hoặc chất điện li nóng chảy.
b) Trong quá trình điện phân, ở cực âm, chất nào có tính oxi hoá ...(1)... được ưu tiên điện phân trước. Ở cực dương, chất nào có tính khử ...(2)... được ưu tiên điện phân trước. Điện phân có nhiều ứng dụng quan trọng trong thực tiễn, như sản xuất kim loại ...(3)..., mạ điện, ...(4)....
Lời giải:
a. (1) oxi hóa - khử; (2) dòng điện 1 chiều.
b. (1) mạnh hơn; (2) mạnh hơn; (3) mạnh (Na, Al…..); (4) tinh chế kim loại.
Bài 12.2 trang 42 Sách bài tập Hóa học 12: Phát biểu nào sau đây về thứ tự điện phân trong dung dịch của các ion kim loại ở điện cực là đúng?
A. Ion kim loại ứng với thế điện cực chuẩn dương hơn sẽ được điện phân trước ở cực âm.
B. Ion kim loại ứng với thế điện cực chuẩn âm hơn sẽ được điện phân trước ở cực âm.
C. Ion kim loại ứng với thế điện cực chuẩn dương hơn sẽ được điện phân trước ở cực dương.
D. Ion kim loại ứng với thế điện cực chuẩn âm hơn sẽ được điện phân trước ở cực dương.
Lời giải:
Đáp án đúng là: A
Ion kim loại ứng với thế điện cực chuẩn dương hơn sẽ được điện phân trước ở cực âm.
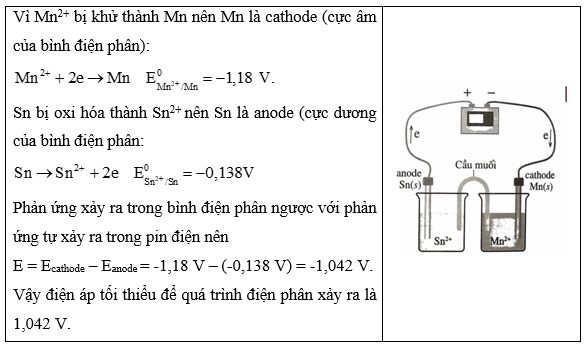
Bài 12.3 trang 42 Sách bài tập Hóa học 12: Vẽ một bình điện phân trong đó Mn2+ bị khử thành Mn và Sn bị oxi hoá thành Sn2+ . Ghi nhãn cho cực dương và cực âm, chỉ ra hướng chuyển động của các electron và viết phương trình hoá học xảy ra ở mỗi điện cực. Điện áp tối thiểu cần thiết để xảy ra sự điện phân là bao nhiêu? Biết E0Mn2+/Mn=−1,18V.
Lời giải:
Bài 12.4 trang 42 Sách bài tập Hóa học 12: Khi điện phân dung dịch NaCl có màng ngăn, các chất được tạo ra ở anode (cực dương) và cathode (cực âm) lần lượt là
A. Cl2 và NaOH, H2.
B. Na và Cl2.
C. Cl2 và Na.
D. NaOH và H2.
Lời giải:
Đáp án đúng là: A
Bài 12.5 trang 42 Sách bài tập Hóa học 12: Điện phân dung dịch hỗn hợp gồm HCl và CuSO4 có cùng nồng độ. Các chất được tạo ra đầu tiên ở anode (cực dương) và ở cathode (cực âm) lần lượt là:
A.Cl2 và H2.
B.Cl2 và Cu.
C. O2 và Cu.
D. O2 và H2.
Lời giải:
Đáp án đúng là: B
- Tại điện cực dương (anode) có:
Vì Cl− được ưu tiên điện phân trước, nên chất tạo ra đầu tiên ở anode là Cl2.
2Cl− → Cl2 + 2e
- Tại điện cực âm (cathode) có: Cu2+, H+, H2O.
Vì Cu2+ được ưu tiên điện phân trước, nên chất tạo ra đầu tiên ở cathode là Cu.
Cu2+ + 2e → Cu
Bài 12.6 trang 42 Sách bài tập Hóa học 12: Điện phân dung dịch NaCl có màng ngăn với cường độ dòng điện 10A trong 2 giờ. Tính khối lượng dung dịch giảm sau khi điện phân, giả thiết chỉ có phản ứng điện phân dung dịch NaCl, bỏ qua lượng nước bay hơi. Cho biết các công thức:
Q = n.F = I.t, trong đó: Q là điện lượng (C), n là số mol electron đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (96500Cmol−1).
Lời giải:
NaCl(aq)→Na+(aq)+Cl(aq)−
Số mol electron trao đổi tại các điện cực
ne=ItF=10.3600.296500=0,746(mol).
Ở cathode (cực âm): Na+, H2O.
2H2O+2e→H2(
0,746 → 0,373 mol
Ở anode (cực dương): Cl-, H2O
0,373 ← 0,746 mol
Khối lượng dung dịch giảm là do Cl2 và H2 bay hơi.
Khối lượng dung dịch giảm là: 0,373 (2 + 71) = 27,229 gam.
Bài 12.7 trang 43 Sách bài tập Hóa học 12: Một loại quặng nhôm có chứa 40% khối lượng Al.
a) Nhôm trong loại quặng trên ở dạng Al2O3, hỏi quặng trên chứa bao nhiêu phần trăm tạp chất.
b) Để điện phân toàn bộ lượng Al2O3 nóng chảy thu được từ 1000 kg loại quặng trên bởi dòng điện một chiều có cường độ 10000 A thì về lí thuyết cần bao nhiêu giờ điện phân liên tục? Cho biết số mol electron n đi qua dây dẫn được tính theo công thức n = (I.t)/F.
Trong đó, I là cường độ dòng điện (A), t là thời gian (s), F là số Faraday (96500 C.mol-1).
Lời giải:
a. Khối lượng Al có trong 1000kg quặng là 400kg tương ứng với khối lượng Al2O3 là
Vậy phần trăm tạp chất trong loại quặng trên là
b. Số mol Al trong 1000kg quặng trên là
Số mol electron cần cho quá trình điện phân là
3.14815 = 44 445 mol vì Al3+ + 3e → Al.
Áp dụng công thức tính được t = 428894,25 s = 119,14 giờ.
Bài 12.8 trang 43 Sách bài tập Hóa học 12: Khi điện phân dung dịch CuSO4, ion nào sẽ điện phân đầu tiên ở cathode?
A. Cu2+.
B. H+ (của nước).
C. SO42-.
D. OH- (của nước).
Lời giải:
Đáp án đúng là: A
Ở cathode có thể xảy ra sự khử ion Cu2+ hoặc H2O. Tuy nhiên, ion Cu2+ dễ bị khử hơn H2O nên Cu2+ được ưu tiên điện phân trước:
Cu2+ + 2e → Cu
Bài 12.9 trang 43 Sách bài tập Hóa học 12: Dựa vào các giá trị thế điện cực chuẩn sau, hãy giải thích vì sao khi điện phân dung dịch NaCl có màng ngăn lại không thu được Na kim loại. Viết phương trình phản ứng điện phân đầu tiên xảy ra ở cathode.
|
Cặp oxi hoá – khử |
2H2O/H2+2OH- |
Na+/Na |
|
Thế điện cực chuẩn (V) |
-0,83 |
-2,71 |
Lời giải:
Do thế điện cực chuẩn lớn hơn nên H2O có tính oxi hóa mạnh hơn Na+, do vậy sẽ bị điện phân trước ở cathode (cực âm) theo phương trình:
2H2O + 2e → H2 + 2OH-
Bài 12.10 trang 43 Sách bài tập Hóa học 12: Trong một dung dịch có đồng thời các ion kim loại: Fe2+, Cu2+, Ag+, Zn2+. Hãy lập luận để chỉ ra thứ tự điện phân của các ion ở cathode.
Lời giải:
Dựa theo bảng thế điện cực chuẩn
|
Cặp oxi hóa khử |
Fe2+/Fe |
Cu2+/Cu |
Ag+/Ag |
Zn2+/Zn |
|
Thế điện cực chuẩn V |
-0,440 |
0,340 |
0,799 |
-0,763 |
Vì thế điện cực chuẩn càng lớn thì dạng oxi hóa có tính oxi hóa càng mạnh, do đó được điện phân trước. Vậy thứ tự điện phân ở cathode lần lượt là Ag+, Cu2+, Fe2+, Zn2+.
Bài 12.11 trang 43 Sách bài tập Hóa học 12: Cần mạ một lớp Ag lên một mặt của một chiếc đĩa tròn có bán kính 12 cm. Với độ dày lớp mạ là 0,01 mm, nếu được cung cấp nguồn điện một chiều có cường độ dòng điện I = 2 A trong thời gian t = 3 giờ thì có đủ để mạ theo yêu cầu trên không? Biết rằng khối lượng riêng của Ag là 10,5 g cm-3, hiệu suất điện phân là 100%.
Lời giải:
Diện tích của mặt đĩa là S =
Thể tích của lớp mạ Ag cần là
V = S.d = 452,16.0,001 = 0,45216 cm3
Khối lượng Ag cần để mạ là
M = V.d = 0,45216.10,5 = 4,75 gam
Số mol Ag cần để mạ là
4,75: 108 = 0,044 mol
Từ phản ứng điện phân xảy ra ở điện cực:
Số mol electron cần cho điện phân lượng Ag trên là 0,044 mol
Theo công thức
Vậy lượng điện cung cấp trong thời gian trên đủ để mạ điện chiếc đĩa nói trên.
Xem thêm các chương trình khác:
- Soạn văn 12 Cánh diều (hay nhất)
- Văn mẫu 12 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 12 – Cánh diều
- Tác giả tác phẩm Ngữ văn 12 - Cánh diều
- Bố cục tác phẩm Ngữ văn 12 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 12 – Cánh diều
- Giải sgk Toán 12 – Cánh diều
- Giải Chuyên đề học tập Toán 12 – Cánh diều
- Lý thuyết Toán 12 – Cánh diều
- Giải sbt Toán 12 – Cánh diều
- Giải sgk Tiếng Anh 12 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 12 – iLearn Smart World
- Giải sgk Vật lí 12 – Cánh diều
- Giải Chuyên đề học tập Vật lí 12 – Cánh diều
- Lý thuyết Vật lí 12 – Cánh diều
- Giải sbt Vật lí 12 – Cánh diều
- Giải sgk Sinh học 12 – Cánh diều
- Giải Chuyên đề học tập Sinh học 12 – Cánh diều
- Lý thuyết Sinh học 12 – Cánh diều
- Giải sbt Sinh học 12 – Cánh diều
- Giải sgk Lịch sử 12 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 12 – Cánh diều
- Giải sbt Lịch sử 12 – Cánh diều
- Giải sgk Địa lí 12 – Cánh diều
- Giải Chuyên đề học tập Địa lí 12 – Cánh diều
- Giải sbt Địa lí 12 – Cánh diều
- Giải sgk Tin học 12 – Cánh diều
- Giải Chuyên đề học tập Tin học 12 – Cánh diều
- Giải sbt Tin học 12 – Cánh diều
- Lý thuyết Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 – Cánh diều
- Giải sgk Kinh tế pháp luật 12 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Cánh diều
- Giải sbt Kinh tế pháp luật 12 – Cánh diều
- Giải sgk Giáo dục quốc phòng 12 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 – Cánh diều