Sách bài tập Hóa 12 Bài 11 (Cánh diều): Nguồn điện hoá học
Với giải sách bài tập Hóa 12 Bài 11: Nguồn điện hoá học sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa 12 Bài 11.
Giải SBT Hóa 12 Bài 11: Nguồn điện hoá học
Bài 11.1 trang 38 Sách bài tập Hóa học 12: Điền từ hoặc cụm từ thích hợp vào chỗ trống trong các câu sau.
a) Nguồn điện ...(1)... là một loại nguồn điện được tạo ra bằng cách sử dụng các phản ứng hoá học để tạo ra ...(2)....
b) Phản ứng trong pin điện hoá diễn ra trong điều kiện …(1)... (tương ứng với hai điện cực) ở hai khu vực khác nhau được nối với nhau bởi dây dẫn. Khi đó, dòng electron được chuyển gián tiếp từ ...(2)... sang chất oxi hoá thông qua dây dẫn điện, ta có pin ...(3)...
Lời giải:
a) (1) hoá học, (2) điện năng.
b) (1) cặp oxi hoá khử, (2) chất khử, (3) điện hoá.
Bài 11.2 trang 38 Sách bài tập Hóa học 12: Những phát biểu nào sau đây là không đúng?
(a) Một ưu điểm của acquy là tái sử dụng được nhiều lần.
(b) Phản ứng xảy ra trong acquy cũng giống như phản ứng xảy ra trong pin Galvani nhưng có thể đảo ngược.
(c) Acquy không gây ô nhiễm môi trường.
(d) Acquy là nguồn điện hoá học có thể hoạt động liên tục.
Lời giải:
a) Đúng.
b) Đúng.
c) Sai. Trong acquy có chứa các thành phần gây ô nhiễm môi trường.
d) Sai. Khi sử dụng acquy một thời gian cần phải sạc acquy lại.
Bài 11.3 trang 38 Sách bài tập Hóa học 12: Nhận định nào sau đây về pin nhiên liệu là không đúng?
A. Khác với acquy, chất phản ứng của pin nhiên liệu phải được cung cấp liên tục từ nguồn bên ngoài.
B. Pin nhiên liệu tạo ra điện năng nhờ năng lượng mặt trời.
C. Pin nhiên liệu biến đổi trực tiếp năng lượng hoá học thành điện năng.
D. Một trong những hạn chế của pin nhiên liệu là sự lưu trữ nhiên liệu.
E. Khi sử dụng, pin nhiên liệu không gây ô nhiễm môi trường.
Lời giải:
A. Đúng.
B. Sai. Điện năng sinh ra từ pin nhiên liệu là nhờ quá trình giải phóng điện tử của nhiên liệu.
C. Đúng.
D. Đúng.
E. Sai. Một số loại pin nhiên nhiệu sử dụng các nguồn nhiên liệu hoá thạch vẫn sản sinh ra khí thải gây ô nhiễm môi trường
Bài 11.4 trang 39 Sách bài tập Hóa học 12: Trong pin Galvani, thành phần nào dưới đây không phải là một phần cấu tạo nhất định phải có trong pin?
A. Điện cực dương.
B. Điện cực âm.
C. Cầu muối.
D. Dây dẫn điện.
Lời giải:
Đáp án đúng là: D
Trong pin Galvani, thành phần không phải là một phần cấu tạo nhất định phải có trong pin: dây dẫn điện.
Bài 11.5 trang 39 Sách bài tập Hóa học 12: Khi nói về cầu muối trong pin Galvani, mỗi phát biểu sau đây là đúng hay sai?
(a) Cầu muối có tác dụng trung hoà điện tích của dung dịch trong pin.
(b) Cầu muối cho phép dòng điện chạy qua.
(c) Dòng điện chạy qua cầu muối là dòng electron.
(d) Muối trong cầu muối luôn cố định là KCl.
Lời giải:
(a) Đúng.
(b) Đúng.
(c) Sai. Dòng điện qua cầu muối là dòng các ion
(d) Sai. Muối được dùng trong cầu muối có thể là NaCl, NH4Cl…
Bài 11.6 trang 39 Sách bài tập Hóa học 12: Bảng dưới đây mô tả các thành phần của pin Galvani và vai trò của từng thành phần. Hoàn thiện những thông tin còn thiếu trong bảng sau.
|
Thành phần |
Vai trò |
Ví dụ |
|
? |
Nơi diễn ra phản ứng khử |
? |
|
Điện cực âm (anode) |
? |
Zn |
|
Dung dịch chứa ion của điện cực âm |
Môi trường cho phản ứng oxi hoá |
? |
|
? |
Môi trường cho phản ứng khử |
Dung dịch AgNO3 |
|
? |
KNO3 |
Lời giải:
|
Thành phần |
Vai trò |
Ví dụ |
|
Điện cực dương (cathode) |
Nơi diễn ra phản ứng khử |
Ag |
|
Điện cực âm (anode) |
Nơi diễn ra phản ứng oxi hoá |
Zn |
|
Dung dịch chứa ion của điện cực âm |
Môi trường cho phản ứng oxi hoá |
Zn(NO3)2 |
|
Dung dịch chứa ion của điện cực dương |
Môi trường cho phản ứng khử |
Dung dịch AgNO3 |
|
Cầu muối |
Trung hoà điện tích của dung dịch trong pin |
KNO3 |
Bài 11.7 trang 39 Sách bài tập Hóa học 12: Một pin Galvani được cấu tạo bởi hai cặp oxi hoá – khử sau:
(1) Ag+ + 1e → Ag EoAg+/Ag = 0,799 V
(2) Ni2+ + 2e → Ni EoNi2+/Ni = -0,257 V
Khi pin làm việc ở điều kiện chuẩn, nhận định nào sau đây là đúng?
A. Ag được tạo ra ở cực dương, Ni được tạo ra ở cực âm.
B. Ag được tạo ra ở cực dương, Ni2+ được tạo ra ở cực âm.
C. Ag+ được tạo ra ở cực âm và Ni được tạo ra ở cực dương.
D. Ag được tạo ra ở cực âm và Ni2+ được tạo ra ở cực dương.
Lời giải:
Đáp án đúng là: B
Dựa vào thế điện cực chuẩn của các cặp oxi hoá - khử: Ag được tạo ra ở cực dương, Ni2+ được tạo ra ở cực âm.
Bài 11.8 trang 39 Sách bài tập Hóa học 12: Sức điện động chuẩn của pin Galvani được tính như thế nào?
A. Bằng hiệu của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
B. Bằng tổng của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
C. Bằng tích của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
D. Bằng thương của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
Lời giải:
Đáp án đúng là: A
Sức điện động chuẩn của pin Galvani được tính bằng hiệu của thế điện cực chuẩn tương ứng của điện cực dương và điện cực âm.
Bài 11.9 trang 40 Sách bài tập Hóa học 12: Nếu thế khử chuẩn của điện cực dương là 0,80 V và thế khử chuẩn của điện cực âm là –0,76 V thì sức điện động chuẩn của pin Galvani tạo từ hai điện cực trên là bao nhiêu?
A. 1,56 V. B. -1,56 V. C. 0,04 V. D. -0,04 V.
Lời giải:
Đáp án đúng là: A
E0pin =E0(+)−E0(−) = 0,80 - (-0,76) = 1,56V.
Bài 11.10 trang 40 Sách bài tập Hóa học 12: Khi nói về pin Galvani, mỗi phát biểu sau đây là đúng hay sai?
(a) Sức điện động chuẩn của pin Galvani có thể mang giá trị âm.
(b) Khi pin Galvani hoạt động, không có phản ứng hoá học diễn ra.
(c) Pin Galvani cung cấp nguồn điện hoá học.
(d) Sức điện động chuẩn của pin Galvani chỉ có thể mang giá trị dương.
Lời giải:
(a) Sai. Sức điện động của pin luôn dương.
(b) Sai. Khi pin Galvani hoạt động, tại hai điện cực, xảy ra quá trình oxi hoá và quá trình khử.
(c) Đúng.
(d) Đúng.
Bài 11.11 trang 40 Sách bài tập Hóa học 12: Khi làm việc, acquy là thiết bị sinh ra dòng điện hoạt động theo nguyên tắc giống như pin Galvani (quá trình acquy phóng điện). Nhưng khác với pin Galvani, acquy có thể tái sử dụng nhờ dùng một dòng điện bên ngoài “ép” phản ứng điện hoá xảy ra khi acquy làm việc theo chiều ngược lại (quá trình sạc điện).
Cho 4 phản ứng sau:
(1) Pb + SO2−4 → PbSO4 + 2e
(2) PbO2 + SO2−4 + 4H+ + 2e → PbSO4 + 2H2O
(3) Pb + PbO2 + 2SO2−4 + 4H+ → 2PbSO4 + 2H2O
(4) 2PbSO4 + 2H2O → Pb + PbO2 + 2SO2−4 + 4H+
Hãy chỉ ra:
a) Phản ứng điện hoá xảy ra ở cực dương khi acquy làm việc.
b) Phản ứng điện hoá xảy ra ở cực âm khi acquy làm việc.
c) Phản ứng điện hoá tổng quát xảy ra khi acquy làm việc.
d) Phản ứng xảy ra khi acquy sạc điện.
Lời giải:
(a) Khi làm việc, cực dương xảy ra sự khử
⇒ Phản ứng (2): PbO2 + SO2−4 + 4H+ + 2e → PbSO4 + 2H2O
(b) Khi làm việc, cực âm xảy ra sự oxi hoá
⇒ Phản ứng (1): Pb + SO2−4 → PbSO4 + 2e
(c) Phản ứng tổng quát của pin
⇒ Phản ứng (3): Pb + PbO2 + 2SO2−4 + 4H+ → 2PbSO4 + 2H2O
(d) Khi sạc pin
⇒ Phản ứng (4) 2PbSO4 + 2H2O → Pb + PbO2 + 2SO2−4 + 4H+
Bài 11.12 trang 40 Sách bài tập Hóa học 12: Xét pin Galvani hoạt động với phương trình tương ứng như sau:
Zn + HgO → ZnO + Hg
Quá trình nào sau đây xuất hiện ở anode?
A. HgO + 2e → Hg + O2-
B. Zn2+ + 2e → Zn
C. Zn → Zn2+ + 2e
D. Hg + O2- → HgO + 2e
Lời giải:
Đáp án đúng là: C
Ở anode xảy ra quá trình nhường electron, cụ thể: Zn → Zn2+ + 2e
Bài 11.13 trang 41 Sách bài tập Hóa học 12: Xét pin Galvani hoạt động với phương trình tương ứng:
Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq)
Những phương án nào sau đây là đúng?
(a) Điện cực đồng giảm khối lượng và điện cực đồng là cực âm.
(b) Điện cực đồng tăng khối lượng và điện cực đồng là cực dương.
(c) Điện cực kẽm giảm khối lượng và điện cực kẽm là cực âm.
(d) Điện cực kẽm tăng khối lượng và điện cực kẽm là cực dương.
Lời giải:
(a) Sai. Điện cực Cu là cực dương và khối lượng sẽ tăng sau khi phản ứng
(b) Đúng.
(c) Đúng.
(d) Sai. Kẽm sẽ bị oxi hoá, là cực âm và tan dần sau khi phản ứng.
Bài 11.14* trang 41 Sách bài tập Hóa học 12: Cho một pin Galvani với điện cực Zn và Cu có sức điện động chuẩn là 1,34 V. Sử dụng pin này để thắp sáng một bóng đèn nhỏ với cường độ dòng điện chạy qua là I = 0,02 A. Nếu điện cực kẽm hao mòn 0,1 mol do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là bao nhiêu giờ? Cho biết các công thức:
Q = n.F = I.t, trong đó: Q là điện lượng (C), n là số mol electron đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (96 500 C mol-1).
Lời giải:
Ta có: Q = n.F = I.t
⇔ 0,1 × 2 × 96500 = 0,02 × t ⇒ t = 965000s = 268 giờ.
Bài 11.15 trang 41 Sách bài tập Hóa học 12: Trong pin nhiên liệu hydrogen, H2 có vai trò tương tự như kim loại mạnh hơn trong pin Galvani. Phản ứng nào sau đây diễn ra ở điện cực dương khi pin nhiên liệu hydrogen hoạt động?
A. 2H2 + O2 → 2H2O
B. H2 → 2H+ + 2e
C. O2 + 4H+ + 4e- → 2H2O
D. 2H+ + 2e → H2
Lời giải:
Đáp án đúng là: C
Phản ứng diễn ra ở cực dương khi pin nhiên liệu hydrogen hoạt động:
O2 + 4H+ + 4e- → 2H2O
Bài 11.16 trang 41 Sách bài tập Hóa học 12: Những phát biểu nào sau đây về pin nhiên liệu là đúng?
(a) Cho hiệu suất chuyển hoá điện năng cao.
(b) Biến đổi trực tiếp hoá năng thành điện năng nhờ quá trình oxi hoá trực tiếp nhiên liệu.
(c) Gây ô nhiễm môi trường khi hoạt động.
(d) Hoạt động liên tục không nghỉ nếu nhiên liệu được cung cấp liên tục.
Lời giải:
(a) Đúng.
(b) Sai. Do oxi hoá gián tiếp.
(c) Sai. Đa số các pin nhiên liệu sử dụng nhiên liệu là hydrogen nên không sinh ra sản phẩm gây ô nhiễm
(d) Đúng.
Lý thuyết Nguồn điện hoá học
I. Cấu tạo và nguyên tắc hoạt động của Pin Galvani
1. Cấu tạo
Một pin Galvani được tạo nên từ hai cặp oxi hóa – khử khác nhau (ví dụ Cu2+/Cu và Zn2+/Zn, gọi là pin Galvani Zn – Cu) thường có cấu tạo như sau:
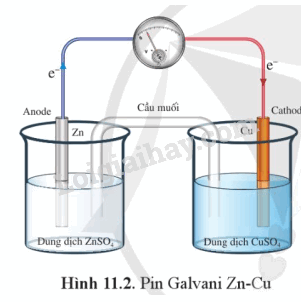
Hai dung dịch muối trong pin Galvani được nối với nhau bởi một cầu muối.
2. Nguyên tắc hoạt động
Nguyên tắc hoạt động của pin Galvani dựa trên phản ứng oxi hóa – khử tự diễn biến, trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
Ví dụ:

3. Sức điện động của pin điện hóa
Sức điện động chuẩn cuẩ pin (Eopin) tạo từ hai cặp oxi hóa – khử Xm+/X và Yn+/Y (trong đó EoXn+/X<EoYn+/Y) được tính theo công thức sau: Eopin=EoYn+/Y−EoXm+/X
II. Giới thiệu một số loại pin thông dụng khác
1. Acquy
Acquy là một loại pin có thể tái sử dụng nhiều lần bằng cách sạc điện. Acquy thường được phân loại dựa theo bản chất vật liệu làm điện cực.
2. Pin nhiên liệu
Pin nhiên liệu là loại pin biến đổi trực tiếp năng lượng hóa học (hóa năng) thành điện năng nhờ quá trình oxi hóa gián tiếp nhiên liệu diễn ra trong pin. Chất oxi hóa thường dùng trong pin nhiên liệu là oxygen
3. Pin mặt trời
Pin mặt trời là loại pin biến đổi trực tiếp quang năng thành điện năng.
Xem thêm các chương trình khác:
- Soạn văn 12 Cánh diều (hay nhất)
- Văn mẫu 12 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 12 – Cánh diều
- Tác giả tác phẩm Ngữ văn 12 - Cánh diều
- Bố cục tác phẩm Ngữ văn 12 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 12 – Cánh diều
- Giải sgk Toán 12 – Cánh diều
- Giải Chuyên đề học tập Toán 12 – Cánh diều
- Lý thuyết Toán 12 – Cánh diều
- Giải sbt Toán 12 – Cánh diều
- Giải sgk Tiếng Anh 12 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 12 – iLearn Smart World
- Giải sgk Vật lí 12 – Cánh diều
- Giải Chuyên đề học tập Vật lí 12 – Cánh diều
- Lý thuyết Vật lí 12 – Cánh diều
- Giải sbt Vật lí 12 – Cánh diều
- Giải sgk Sinh học 12 – Cánh diều
- Giải Chuyên đề học tập Sinh học 12 – Cánh diều
- Lý thuyết Sinh học 12 – Cánh diều
- Giải sbt Sinh học 12 – Cánh diều
- Giải sgk Lịch sử 12 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 12 – Cánh diều
- Giải sbt Lịch sử 12 – Cánh diều
- Giải sgk Địa lí 12 – Cánh diều
- Giải Chuyên đề học tập Địa lí 12 – Cánh diều
- Giải sbt Địa lí 12 – Cánh diều
- Giải sgk Tin học 12 – Cánh diều
- Giải Chuyên đề học tập Tin học 12 – Cánh diều
- Giải sbt Tin học 12 – Cánh diều
- Lý thuyết Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 – Cánh diều
- Giải sgk Kinh tế pháp luật 12 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Cánh diều
- Giải sbt Kinh tế pháp luật 12 – Cánh diều
- Giải sgk Giáo dục quốc phòng 12 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 – Cánh diều
