Pha chế 50 ml dung dịch natri clorua có nồng độ 0,1M
Với giải thực hành 4 trang 153 sgk Hóa học lớp 8 được biên soạn lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập môn Hóa 8. Mời các bạn đón xem:
Giải Hóa 8 Bài 45: Bài thực hành 7: Pha chế dung dịch theo nồng độ
Thực hành 4 trang 153 Hóa học 8: Pha chế 50 ml dung dịch natri clorua có nồng độ 0,1M từ dung dịch natri clorua có nồng độ 0,2 M ở trên.
Phần tính toán
Đổi 50 ml = 0,05 lít
Số mol chất tan (NaCl) có trong 50 ml dung dịch 0,1M cần pha chế là:
nNaCl = CM.V = 0,1.0,05 = 0,005 mol
+ Thể tích dung dịch NaCl 0,2M trong đó có chứa 0,005 mol NaCl là:
CM’ =
→ V’ = =
= 0,025 lít = 25 ml
Phần thực hành:
|
Chuẩn bị |
Cách tiến hành |
|
- Dụng cụ: + Cốc chia độ có dung tích 100 ml. + Ống đong + Đũa, thìa. |
- Đong 25 ml dung dịch NaCl 0,2M cho vào cốc chia độ - Rót từ từ nước vào cốc đến vạch 50 ml. - Khuấy đều → Ta được 50 ml dung dịch NaCl 0,1M
|
|
- Hóa chất + Dung dịch NaCl 0,2M đã pha chế được ở thí nghiệm trên. + Nước cất. |
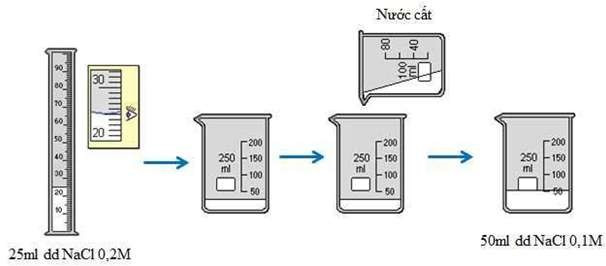
Hình 4: Quá trình pha chế 50ml dung dịch NaCl 0,1M
Xem thêm lời giải sách bài tập Hóa học lớp 8 hay, chi tiết khác:
Thực hành 1 trang 152 Hóa 8: Pha chế 50 g dung dịch đường có nồng độ 15%...
Thực hành 2 trang 152 Hóa 8: Pha chế 100 ml dung dịch natri clorua có nồng độ 0,2M...
Thực hành 3 trang 153 Hóa 8: Pha chế 50 g dung dịch đường 5% từ dung dịch đường có nồng độ 15% ở trên...
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 8 (hay nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Soạn văn 8 (ngắn nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Văn mẫu lớp 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Vật Lí 8
- Giải sbt Vật Lí 8
- Lý thuyết Vật Lí 8
- Giải vở bài tập Vật lí 8
- Giải SGK Toán 8 | Giải bài tập Toán 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Toán 8 (sách mới) | Sách bài tập Toán 8
- Bài tập Ôn luyện Toán lớp 8
- Các dạng bài tập Toán lớp 8
- Lý thuyết Toán lớp 8 (sách mới) | Kiến thức trọng tâm Toán 8
- Giáo án Toán lớp 8 mới nhất
- Bài tập Toán lớp 8 mới nhất
- Chuyên đề Toán lớp 8 mới nhất
- Giải sgk Tiếng Anh 8 (sách mới) | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2
- Giải sgk Tiếng Anh 8 | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 8 (sách mới) | Sách bài tập Tiếng Anh 8
- Giải sbt Tiếng Anh 8 (thí điểm)
- Giải sgk Tin học 8 | Giải bài tập Tin học 8 Học kì 1, Học kì 2 (sách mới)
- Giải sgk Lịch Sử 8 | Giải bài tập Lịch sử 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch sử 8 (sách mới) | Kiến thức trọng tâm Lịch sử 8
- Giải vở bài tập Lịch sử 8
- Giải Tập bản đồ Lịch sử 8
- Đề thi Lịch Sử 8
- Giải vở bài tập Sinh học 8
- Giải sgk Sinh học 8
- Lý thuyết Sinh học 8
- Giải sgk Giáo dục công dân 8 | Giải bài tập Giáo dục công dân 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Giáo dục công dân 8 (sách mới) | Kiến thức trọng tâm GDCD 8
- Lý thuyết Địa Lí 8 (sách mới) | Kiến thức trọng tâm Địa Lí 8
- Giải sgk Địa Lí 8 | Giải bài tập Địa Lí 8 Học kì 1, Học kì 2 (sách mới)
- Giải Tập bản đồ Địa Lí 8
- Đề thi Địa lí 8
