Trắc nghiệm tổng hợp Hóa 10 Chủ đề 6: Tốc độ phản ứng hóa học có đáp án
Trắc nghiệm Hóa 10 Dạng 1. Câu hỏi lí thuyết Tốc độ phản ứng hóa học có đáp án
-
973 lượt thi
-
30 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
15/07/2024Hoàn toàn có thể dựa vào sự thay đổi của đại lượng nào trong một đơn vị thời gian để đánh giá mức độ nhanh, chậm của phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Hoàn toàn có thể dựa vào sự thay đổi nồng độ của chất phản ứng (hoặc chất sản phẩm) trong một đơn vị thời gian để đánh giá mức độ nhanh, chậm của phản ứng.
Câu 2:
18/07/2024Tốc độ phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Câu 3:
22/07/2024Yếu tố nào sau đây không làm ảnh hưởng đến tốc độ phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các yếu tố ảnh hưởng đến tốc độ phản ứng là: nồng độ, áp suất, diện tích bề mặt, nhiệt độ, chất xúc tác.
Vậy khối lượng chất rắn không ảnh hưởng đến tốc độ phản ứng.
Câu 4:
03/07/2024Chất xúc tác là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả lượng và chất sau khi phản ứng kết thúc.
Câu 5:
03/07/2024
Yếu tố nào sau đây luôn làm tăng tốc độ phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tăng diện tích tiếp xúc giữa các chất phản ứng làm tăng tốc độ phản ứng.
Câu 6:
15/07/2024Thông thường đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Thông thường đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng.
Câu 7:
17/07/2024Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tốc độ phản ứng cho biết mức độ nhanh chậm của một phản ứng hóa học.
Câu 8:
22/07/2024Thực hiện 2 thí nghiệm theo hình vẽ sau.
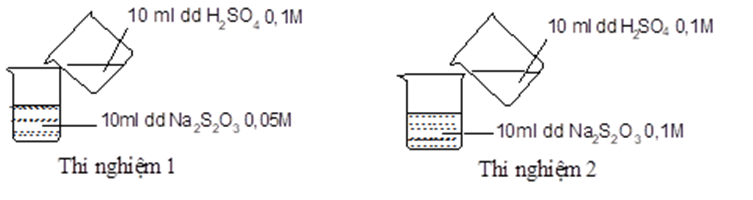
Ở thí nghiệm nào xuất hiện kết tủa trước?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Ở thí nghiệm 2 có kết tủa xuất hiện trước do nồng độ Na2S2O3 ở thí nghiệm 2 lớn hơn so với ở thí nghiệm 1.
Câu 9:
20/07/2024Cho cùng một lượng kẽm (zinc) vào các cốc khác nhau chứa cùng một lượng dung dịch hydrochloric acid, trường hợp nào sẽ có tốc độ phản ứng nhanh nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cùng một lượng kẽm thì kẽm ở dạng bột mịn có diện tích bề mặt lớn nhất.
Vậy tốc độ phản ứng diễn ra nhanh nhất khi sử dụng kẽm ở dạng bột mịn và khuấy nhẹ.
Câu 10:
20/07/2024Cho các phản ứng sau:
(1) Phản ứng than cháy trong không khí.
(2) Phản ứng tạo gỉ sắt.
(3) Phản ứng nổ của khí bình gas.
(4) Phản ứng lên men rượu.
Phản ứng xảy ra với tốc độ nhanh nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phản ứng xảy ra với tốc độ nhanh nhất là:
(3) Phản ứng nổ của khí bình gas.
Câu 11:
20/07/2024Chọn đáp án đúng nhất. Tốc độ tức thời của phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
Câu 12:
23/07/2024Khi nồng độ chất tham gia phản ứng càng lớn thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khi nồng độ chất tham gia phản ứng càng lớn thì tốc độ phản ứng càng lớn.
Câu 13:
14/07/2024Để hạn chế sự ôi thiu thực phẩm do các phản ứng của oxygen cũng như sự hoạt động của vi khuẩn, người ta thường bơm khí nào sau đây vào các túi đựng thực phẩm trước khi đóng gói?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Thực phẩm bị ôi thiu do các phản ứng oxi hóa của oxygen cũng như hoạt động của vi khuẩn. Để hạn chế sự ôi thiu, người ta bơm khí N2 hoặc CO2 vào túi đựng thực phẩm trước khi đóng gói. Khi đó nồng độ khí oxygen sau khi bơm N2 hoặc CO2 chỉ còn 2 – 5%.
Câu 14:
18/07/2024Tốc độ phản ứng tính theo định luật tác dụng khối lượng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng tính theo định luật tác dụng khối lượng là tốc độ tức thời của phản ứng tại một thời điểm.
Câu 15:
23/07/2024Nhận xét nào sau đây là không đúng về hằng số tốc độ phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu D sai vì: Hằng số tốc độ của phản ứng càng lớn thì tốc độ của phản ứng đó càng lớn.
Câu 16:
19/07/2024Phản ứng của H2 và I2 là phản ứng đơn giản:
H2 (g) + I2 (g) → 2HI (g)
Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Theo định luật tác dụng khối lượng, tốc độ của phản ứng được viết dưới dạng là:
\[v = k{C_{{H_2}}}{C_{{I_2}}}.\]
Câu 17:
18/07/2024Nếu chia một vật thành nhiều phẩn nhỏ hơn thì tổng diện tích bề mặt sẽ
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nếu chia một vật thành nhiều phẩn nhỏ hơn thì tổng diện tích bề mặt sẽ tăng lên.
Câu 18:
11/07/2024Hệ số nhiệt độ Van’t Hoff được kí hiệu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hệ số nhiệt độ Van’t Hoff được kí hiệu là γ.
Câu 19:
22/07/2024Chất làm giảm tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Chất làm giảm tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là chất ức chế.
Câu 20:
17/07/2024Biện pháp nào sau đây không làm tăng diện tích bề mặt của khối chất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nếu kích thước hạt càng nhỏ thì tổng diện tích bề mặt càng lớn, nên có thể tăng diện tích tiếp xúc bằng cách đập nhỏ hạt.
Ngoài ra, tạo nhiều đường rãnh, lỗ xốp trong lòng khối chất cũng làm tăng diện tích bề mặt khối chất.
Vậy làm đầy các rãnh trên bề mặt khối chất không làm tăng diện tích bề mặt của khối chất.
Câu 21:
22/07/2024Năng lượng hoạt hóa là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Năng lượng hoạt hóa là năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hóa học.
Câu 22:
22/11/2024Nhận xét nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Với mọi phản ứng, khi tăng áp suất, tốc độ phản ứng tăng là sai.
Vì: Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
- Các yếu tố ảnh hưởng tốc độ phản ứng: + Nồng độ: Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng. Áp suất: Đối với phản ứng có chất khí, khi tăng áp suất, tốc độ phản ứng tăng. Nhiệt độ: Khi tăng nhiệt độ, tốc độ phản ứng tăng.
→ A sai
- Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả lượng và chất sau khi phản ứng kết thúc
→ C sai.
- Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do nồng độ của các chất khí tăng lên.
→ D sai.
* Định luật tác dụng khối lượng
- Thí nghiệm: Cho hai mảnh Zn có cùng khối lượng vào hai bình chứa cùng thể tích dung dịch H2SO4 loãng, dư, nồng độ dung dịch ở mỗi bình lần lượt là 0,5M và 1M.
- Kết luận: Khi nồng độ các chất tham gia phản ứng càng lớn thì tốc độ phản ứng càng lớn.
- Giải thích: Để phản ứng xảy ra, các phân tử phản ứng phải va chạm với nhau, nồng độ càng lớn thì số lượng va chạm càng nhiều (trong cùng một đơn vị thời gian, một đơn vị thể tích) nên tốc độ phản ứng càng lớn.
- Định luật tác dụng khối lượng áp dụng cho các phản ứng đơn giản, biểu thị sự phụ thuộc tốc độ phản ứng theo nồng độ các chất phản ứng.
Lưu ý: Phản ứng đơn giản là phản ứng chỉ diễn ra qua một giai đoạn duy nhất, chất phản ứng tạo thành sản phẩm không qua một chất trung gian nào khác.
- Cho phản ứng tổng quát: aA + bB sản phẩm
+ Tốc độ phản ứng được tính như sau: v = k(4)
+ Trong đó: CA, CB là nồng độ mol. L-1 tương ứng của chất A và B; k là hằng số tốc độ phản ứng mà giá trị của nó chỉ phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
- Định luật tác dụng khối lượng: Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
® Hằng số tốc độ phản ứng càng lớn thì tốc độ phản ứng càng lớn.
- Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1M. Đây chính là ý nghĩa của hằng số tốc độ phản ứng.
Lưu ý: Tốc độ phản ứng tính theo định luật tác dụng khối lượng là tốc độ tức thời của phản ứng tại một thời điểm, khác với tốc độ trung bình của phản ứng trong một khoảng thời gian như đã nêu trên.
II. Các yếu tố ảnh hưởng tới tốc độ phản ứng, hệ số nhiệt độ Van’t Hoff
1. Ảnh hưởng của nồng độ
- Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
+ Giải thích: Khi nồng độ của H2 và I2 tăng lên trong một đơn vị thể tích, các phân tử này cũng sẽ nhiều hơn, dẫn đến số lượng va chạm giữa chúng (trong cùng một đơn vị thời gian) tăng lên. Vì vậy tốc độ phản ứng tăng lên khi nồng độ các chất tăng.
2. Ảnh hưởng của áp suất
- Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng càng lớn.
- Giải thích: Đối với các chất khí, nồng độ của chất khí tỉ lệ với áp suất của nó. Do vậy, khi áp suất chất tham gia phản ứng ở thể khí tăng lên, sẽ làm nồng độ chất khí tăng lên, từ đó làm tốc độ phản ứng tăng.
3. Ảnh hưởng của diện tích bề mặt
- Thí nghiệm: Dùng hai mẫu Zn có cùng khối lượng, trong đó một mẫu dạng hạt còn một mẫu dạng bột. Cho hai mẫu đó cùng tác dụng với hai thể tích bằng nhau dung dịch H2SO4 loãng, dư, cùng nồng độ.
- Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
- Giải thích: Khi diện tích bề mặt tăng lên, dẫn đến số lượng va chạm giữa các chất phản ứng tăng lên (trong cùng một đơn vị thời gian) tăng lên. Vì vậy tốc độ phản ứng tăng lên khi nồng độ các chất tăng.
- Ảnh hưởng của diện tích bề mặt tới tốc độ phản ứng trong thực tế: thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn, than tổ ong có nhiều lỗ sẽ cháy nhanh hơn, ...
4. Ảnh hưởng của nhiệt độ
- Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị g = 2 ÷ 4 này được gọi là hệ số nhiệt độ Van’t Hoff.
- Mối liên hệ của hệ số nhiệt độ Van’t Hoff tới tốc độ và nhiệt độ như sau:
Trong đó, v2 và v1 là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
- Ảnh hưởng của nhiệt độ tới tốc độ phản ứng trong thực tế: Nước nhanh sôi hơn khi được đun ở nhiệt độ cao; thức ăn bị chậm ôi, thiu khi được để trong tủ lạnh, ...
5. Ảnh hưởng của chất xúc tác
- Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị thay đổi cả về lượng và chất sau phản ứng.
Tuy nhiên tốc độ phản ứng phân hủy này sẽ nhanh hơn rất nhiều khi có mặt chất xúc tác MnO2. Kết thúc thí nghiệm trên, màu đen của MnO2 ban đầu vẫn giữ nguyên vì MnO2 không bị biến đổi sau phản ứng phân hủy KClO3.
- Ảnh hưởng của nhiệt độ tới tốc độ phản ứng trong thực tế:
+ Phản ứng tổng hợp NH3 từ N2 và H2 cần sử dụng chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O, ... để làm tăng tốc độ phản ứng, phản ứng không có chất xúc tác sẽ diễn ra rất chậm.
+ Các enzyme trong cơ thể là những chất xúc tác sinh học thúc đẩy các phản ứng sinh hóa phức tạp trong cơ thể chúng ta. Ví dụ enzyme amylase có trong nước ngọt giúp thủy phân tinh bột thành đường.
Xem thêm các bài viết liên quan,chi tiết khác:
Câu 23:
18/07/2024Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng chỉ nhận giá trị dương, do đó phải thêm dấu trừ trong biểu thức tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng.
Câu 24:
21/07/2024Cho phản ứng đơn giản xảy ra trong bình kín:
3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 không đổi và nồng độ N2 tăng 2 lần?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Theo định luật tác dụng khối lượng: \(v = kC_{{H_2}}^3C_{{N_2}}^{}\)
Nếu nồng độ H2 không đổi và nồng độ N2 tăng lên 2 lần, ta có:
\[v' = k\left( {C_{{H_2}}^3} \right)\left( {2.C_{{N_2}}^{}} \right) = 2 \cdot kC_{{H_2}}^3C_{{N_2}}^{} = 2v.\]
Vậy tốc độ phản ứng tăng 2 lần.
Câu 25:
22/07/2024Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Áp dụng công thức:
\( \Rightarrow {v_2} = {v_1} \times {2^{\frac{{40 - 70}}{{10}}}} = {2^{ - 3}}{v_1} = \frac{1}{8}{v_1}\)
Như vậy khi nhiệt độ giảm từ 70oC xuống 40oC thì tốc độ phản ứng giảm 8 lần.
Câu 26:
22/07/2024Tốc độ của một phản ứng hóa học lớn nhất khoảng thời điểm nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các phản ứng khác nhau có tốc độ phản ứng khác nhau, không thể xác định được một cách tổng quát khoảng thời điểm mà tại đó tốc độ phản ứng hóa học là lớn nhất.
Câu 27:
20/07/2024Biểu đồ nào sau đây không biểu diễn sự phụ thuộc nồng độ chất tham gia với thời gian?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Biểu đồ C cho thấy nồng độ tăng dần theo thời gian, do đó biểu đồ này không biểu diễn sự phụ thuộc nồng độ chất tham gia với thời gian.
Câu 28:
04/01/2025Cho phương trình phản ứng tổng quát sau:
2A + B → C
Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức:
\[v = kC_A^2{C_B}\]
Hằng số tốc độ k phụ thuộc vào yếu tố nào sau đây? Xem đáp án
Xem đáp án
Đáp án đúng là: C
Lời giải
Hằng số k đặc trưng cho mỗi phản ứng và chỉ phụ thuộc vào nhiệt độ và bản chất các chất tham gia phản ứng.
*Phương pháp giải:
Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc chất sản phẩm trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d), … Lượng chất có thể biểu diễn bằng số mol, nồng độ mol, khối lượng hoặc thể tích.
*Lý thuyết:
Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Thực nghiệm cho thấy khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng thường tăng từ 2 đến 4 lần.
Gọi vT là tốc độ phản ứng tại nhiệt độ T, vT + 10 là tốc độ phản ứng tại nhiệt độ T + 10, khi đó: .
Trong biểu thức trên, g được gọi là hệ số nhiệt độ Van’t Hoff (Van-Hốp). Giá trị g càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh.
Xem thêm
Lý thuyết Tốc độ phản ứng – Hóa 10 Kết nối tri thứcCâu 29:
03/07/2024Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các biện pháp giúp rút ngắn thời gian tiến hành thí nghiệm: (1); (2); (4).
Câu 30:
20/07/2024Hình ảnh dưới đây minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng:
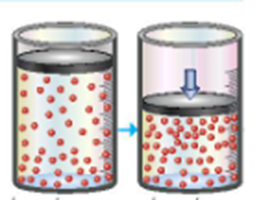
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên hay áp suất tăng lên.
Bài thi liên quan
-
Trắc nghiệm Hóa 10 Dạng 2. Tính tốc độ trung bình của phản ứng có đáp án
-
17 câu hỏi
-
30 phút
-
-
Trắc nghiệm Hóa 10 Dạng 3. Các yếu tố ảnh hưởng đến tốc độ phản ứng có đáp án
-
17 câu hỏi
-
30 phút
-
-
Trắc nghiệm Hóa 10 Dạng 4. Bài tập về hệ số nhiệt độ van't hoff có đáp án
-
12 câu hỏi
-
30 phút
-
Có thể bạn quan tâm
Các bài thi hot trong chương
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 5: Năng lượng hóa học có đáp án (1841 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 7: Nguyên tố nhóm VIIA (Nhóm halogen) có đáp án (1606 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 3: Liên kết hóa học có đáp án (958 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 4: Phản ứng oxi hóa - khử có đáp án (943 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 1: Cấu tạo nguyên tử có đáp án (910 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 2: Bảng tuần hoàn các nguyên tố hóa học có đáp án (819 lượt thi)
