Trắc nghiệm tổng hợp Hóa 10 Chủ đề 6: Tốc độ phản ứng hóa học có đáp án
Trắc nghiệm Hóa 10 Dạng 2. Tính tốc độ trung bình của phản ứng có đáp án
-
1146 lượt thi
-
17 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
15/07/2024Cho phản ứng phân hủy N2O5 như sau:
2N2O5(g) → 4NO2 (g) + O2 (g)
Tại thời điểm ban đầu, nồng độ của N2O5 là 0,02M; Sau 100s, nồng độ N2O5 còn 0,0169M. Tốc độ trung bình của phản ứng phân hủy N2O5 trong 100 s đầu tiên là
Câu 2:
23/07/2024Phản ứng của H2 với I2 là phản ứng đơn giản:
H2(g) + I2(g) → 2HI(g)
Nếu nồng độ của I2 tăng gấp đôi, thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Theo định luật tác dụng khối lượng, tốc độ phản ứng được viết dưới dạng:
υ=kCH2CI2
Khi nồng độ của I2 tăng gấp đôi thì: {\upsilon ^'} = k{C_{{H_2}}}2{C_{{I_2}}} = 2k{C_{{H_2}}}{C_{{I_2}}} = 2\upsilon.
Vậy tốc độ phản ứng tăng 2 lần.
Câu 3:
23/07/2024Cho phản ứng 3O2(g)→2O3(g)
Ban đầu nồng độ oxygen là 0,024M. Sau 5s thì nồng độ của oxygen là 0,02M. Tốc độ trung bình của phản ứng trên trong 5s đầu tiên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tốc độ trung bình của phản ứng trên tính theo oxygen:
ˉv=−13ΔCO2Δt=−13×0,02−0,0245−0=2,67.10−4(Ms−1)
Câu 4:
23/07/2024Cho phản ứng phân hủy N2O5 như sau:
2N2O5 (g) → 4NO2 (g) + O2 (g)
Nồng độ ban đầu của NO2 là 0 M, sau 100 s là 0,0062 M. Tốc độ trung bình của phản ứng trong 100 s đầu tiên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tốc độ trung bình của phản ứng trong 100s đầu tiên là:
\[\overline \upsilon = \frac{1}{4}.\frac{{\Delta {C_{N{O_2}}}}}{{\Delta t}} = \frac{1}{4}.\frac{{(0,0062 - 0)}}{{100 - 0}} = 1,{55.10^{ - 5}}(M{s^{ - 1}})\]
Câu 5:
19/07/2024Hydrogen peroxide phân hủy theo phản ứng sau:
2H2O2 → 2H2O + O2
Tại thời điểm ban đầu, thể tích khí oxygen là 0 cm3, sau thời gian 15 phút thể tích khí oxygen là 16 cm3. Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tốc độ trung bình của phản ứng trong 15 phút đầu tiên là
\[\overline \upsilon = \frac{{\Delta {C_{{O_2}}}}}{{\Delta t}} = \frac{{(16 - 0)}}{{(15 - 0)}}\]≈ 1,067 cm3 phút-1.
Câu 6:
23/07/2024Cho phản ứng hóa học sau:
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
Sau 40 giây, nồng độ của dung dịch HCl giảm tử 0,6 M về còn 0,4 M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tốc độ trung bình của phản ứng theo HCl trong 40 giây là:
¯v=−12ΔCHClΔt=−12.(0,4−0,6)40=2,5×10−3(M/s)
Câu 7:
08/01/2025Cho phản ứng đơn giản sau (xảy ra trong bình kín):
2NO (g) + O2 (g) → 2NO2 (g)
Ở nhiệt độ không đổi, nồng độ NO tăng hai lần, nồng độ O2 không đổi thì
 Xem đáp án
Xem đáp án
Đáp án đúng: C
* Lời giải:
Theo định luật tác dụng khối lượng, tốc độ của phản ứng được viết dưới dạng:
v=kC2NOCO2
Khi nồng độ NO tăng hai lần, nồng độ O2 không đổi thì:
v′=k(2CNO)2CO2=4kC2NOCO2=4v
Hay tốc độ phản ứng tăng 4 lần.
* Phương pháp giải:
vận dụng công thức tính tốc độ phản ứng:
v=k×CaA×CbB
+ Trong đó:
k là hằng số tốc độ phản ứng;
CA; CB là nồng độ (M) chất A, B tại thời điểm đang xét.
* Lý thuyết nắm thêm
Khái niệm tốc độ phản ứng hóa học
- Tốc độ phản ứng của phản ứng hóa học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ phản ứng hóa học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
- Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian).
- Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
- Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó
Tính tốc độ trung bình của phản ứng hóa học
Cho phản ứng tổng quát: aA + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng:
ˉv=−1a×ΔCAΔt=−1b×ΔCBΔt=1c×ΔCCΔt=1d×ΔCDΔt
Trong đó:
ˉv: tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1: biến thiên thời gian
C1, C2 là nồng độ của một chất tại hai thời điểm tương ứng t1 và t2.
- Biểu thức tốc độ phản ứng:
Xét phản ứng đơn giản có dạng: aA + bB → cC + dD
+ Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức:
v=k×CaA×CbB
+ Trong đó:
k là hằng số tốc độ phản ứng;
CA; CB là nồng độ (M) chất A, B tại thời điểm đang xét.
Xem thêm các bài viết liên quan hay, chi tiết:
Lý thuyết Hóa học 10 Chương 6: Tốc độ phản ứng hóa học - Chân trời sáng tạo
Trắc nghiệm tổng hợp Hóa 10 Chủ đề 6: Tốc độ phản ứng hóa học có đáp án
Câu 8:
21/07/2024Cho phương trình hóa học sau: CHCl3 (g) + Cl2 (g) → CCl4 (g) + HCl (g). Khi nồng độ của CHCl3 giảm 2 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ
 Xem đáp án
Xem đáp án
Đáp án đúng là: B.
Theo định luật tác dụng khối lượng, tốc độ phản ứng được viết dưới dạng:
υ=k.CCHCl3.CCl2
Khi nồng độ của CHCl3 giảm 2 lần, nồng độ Cl2 giữ nguyên ta có:
υ′=k.CCHCl32.CCl2=υ2
Vậy khi nồng độ của CHCl3 giảm 2 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ giảm đi một nửa.
Câu 9:
28/10/2024Cho phản ứng hóa học sau:
2SO2 (g) + O2 (g) → 2SO3 (g)
Trong khoảng thời gian 420 giây, nồng độ SO2 giảm từ 0,027 M xuống 0,0194 M. Tốc độ trung bình của phản ứng tính theo nồng độ SO2 trong khoảng thời gian trên là
 Xem đáp án
Xem đáp án
Đáp án đúng : D
* Lời giải:
Tốc độ trung bình của phản ứng tính theo nồng độ SO2 trong 420 giây là:
¯v=−12×ΔCSO2Δt=−12×(0,0194−0,0270)420≈9×10−6(M/s)
* Phương pháp giải:
- Áp dụng côngt hức tính tốc độ trung bình của phản ứng tính theo nồng độ:
ˉv=−1a×ΔCAΔt=−1b×ΔCBΔt=1c×ΔCCΔt=1d×ΔCDΔt
* Lý thuyết cần nắm thêm về tốc độ phản ứng hóa học:
1) Khái niệm tốc độ phản ứng hóa học
- Tốc độ phản ứng của phản ứng hóa học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ phản ứng hóa học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
- Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian).
- Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
- Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó
Tính tốc độ trung bình của phản ứng hóa học
Cho phản ứng tổng quát: aA + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng:
ˉv=−1a×ΔCAΔt=−1b×ΔCBΔt=1c×ΔCCΔt=1d×ΔCDΔt
Trong đó:
ˉv: tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1: biến thiên thời gian
C1, C2 là nồng độ của một chất tại hai thời điểm tương ứng t1 và t2.
2) Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Ảnh hưởng của nồng độ
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
- Giải thích: Nồng độ của các chất phản ứng tăng làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
Chú ý: Khi các chất phản ứng va chạm đúng hướng và đủ năng lượng dẫn đến xảy ra phản ứng, gọi là va chạm hiệu quả.
Ảnh hưởng của nhiệt độ
- Khi tăng nhiệt độ, tốc độ phản ứng tăng.
- Giải thích: Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ; khi tăng nhiệt độ; các chất sẽ chuyển động với tốc độ lớn hơn, dẫn đến tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
- Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức:
vt2vt1=γt2−t110
Trong đó:
+ vt1; vt2là tốc độ phản ứng ở hai nhiệt độ t1 và t2;
+ γ là hệ số nhiệt độ Van’t Hoff.
Chú ý: Quy tắc Van’t Hoff chỉ gần đúng trong khoảng nhiệt độ không cao.
Ảnh hưởng của áp suất
- Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
- Giải thích: Khi tăng áp suất thì nồng độ chất khí tăng, nên tốc độ phản ứng tăng.
Ảnh hưởng của bề mặt tiếp xúc
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
- Giải thích: Khi tăng diện tích tiếp xúc của chất phản ứng, số va chạm hiệu quả tăng dẫn đến tốc độ phản ứng tăng.
Ảnh hưởng của chất xúc tác
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng.
- Chất xúc tác được ghi trên mũi tên trong phương trình hóa học.
Xem thêm các bài viết liên quan hay, chi tiết:
Lý thuyết Hóa học 10 Bài 16 (Cánh diều): Tốc độ phản ứng hóa học
Giải Hóa 10 Bài 16 - Cánh diều: Tốc độ phản ứng hóa học
Trắc nghiệm Tốc độ phản ứng hóa học có đáp án - Hóa học lớp 10
Câu 10:
12/07/2024Cho phản ứng xảy ra như sau:
H2 (g) + Cl2 (g) → 2HCl (g)
Công thức đúng để xác định tốc độ trung bình của phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
H2 (g) + Cl2 (g) → 2HCl (g)
Biểu thức tốc độ trung bình của phản ứng là
¯v=−ΔCH2Δt=−ΔCCl2Δt=ΔCHCl2Δt
Câu 11:
23/07/2024Phản ứng 3H2 (g) + N2 (g) → 2NH3 (g) có tốc độ mất đi của H2 so với tốc độ hình thành NH3 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng bằng 13 tốc độ mất đi của H2 và bằng 12 tốc độ hình thành của NH3.
¯v=13vH2=12vNH3⇒vH2=32vNH3
Câu 12:
19/07/2024Thiết bị sau có thể được sử dụng để đo tốc độ phản ứng của một số phản ứng hóa học:
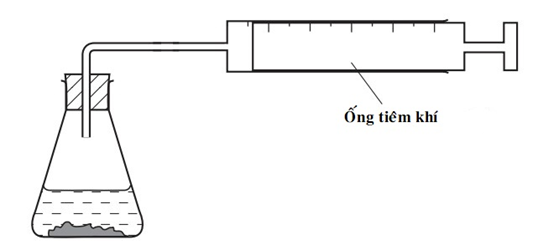
Cho các phản ứng sau:
(1) AgNO3(aq) + HCl(aq) → AgCl(s) + HNO3(aq)
(2) 2H2O2(aq) 2H2O(l) + O2(g)
(3) MgO(s) + 2HCl (aq) → MgCl2(aq) + H2O(l)
(4) ZnCO3(s) + 2HCl (aq) → ZnCl 2(aq) + CO2(g) + H2O(l)
Hai phản ứng phù hợp với thiết bị trên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Thiết bị này được sử dụng để đo tốc độ của một số phản ứng hóa học có sản phẩm thu được là chất khí nên phản ứng số (2) và (4) thỏa mãn thiết bị trên.
(2) 2H2O2(aq) 2H2O(l) + O2(g)
(4) ZnCO3(s) + 2HCl (aq) → ZnCl 2(aq) + CO2(g) + H2O(l)
Câu 13:
17/07/2024Đối với phản ứng tổng quát: aA + bB ® cC + dD
Gọi DCA, DCB, DCC, DCD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian Dt. Tốc độ trung bình của phản ứng được tính theo biểu thức là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Đối với phản ứng tổng quát: aA + bB ® cC + dD
Gọi DCA, DCB, DCC, DCD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian Dt. Tốc độ trung bình của phản ứng được tính theo biểu thức:
vtb=−1a⋅ΔCAΔt=−1b⋅ΔCBΔt=1c⋅ΔCCΔt=1d⋅ΔCDΔt
Câu 14:
21/07/2024Xét phản ứng đơn giản sau: 2NO (g) + O2 (g) ® 2NO (g).
Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng được thể hiện bằng biểu thức:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Xét phản ứng: 2NO (g) + O2 (g) ® 2NO (g).
Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng được biểu diễn bằng biểu thức: v=k⋅C2NO⋅CO2.
Câu 15:
18/07/2024Đâu là đơn vị tốc độ phản ứng ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Đơn vị tốc độ phản ứng là: (đơn vị nồng độ) (đơn vị thời gian)−1
Ví dụ: mol L−1 s−1; M s−1.
Câu 16:
23/07/2024Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tốc độ phản ứng chỉ nhận giá trị dương, do đó phải thêm dấu trừ trong biểu thức tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng.
Câu 17:
14/07/2024Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 và N2 đều tăng 2 lần?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Theo định luật tác dụng khối lượng: v=kC3H2CN2
Nếu nồng độ H2 và N2 đều tăng lên 2 lần, ta có:
v′=k(2.CH2)3(2.CN2)=16⋅kC3H2CN2=16v.
Vậy tốc độ phản ứng tăng 16 lần.
Bài thi liên quan
-
Trắc nghiệm Hóa 10 Dạng 1. Câu hỏi lí thuyết Tốc độ phản ứng hóa học có đáp án
-
30 câu hỏi
-
50 phút
-
-
Trắc nghiệm Hóa 10 Dạng 3. Các yếu tố ảnh hưởng đến tốc độ phản ứng có đáp án
-
17 câu hỏi
-
30 phút
-
-
Trắc nghiệm Hóa 10 Dạng 4. Bài tập về hệ số nhiệt độ van't hoff có đáp án
-
12 câu hỏi
-
30 phút
-
Có thể bạn quan tâm
Các bài thi hot trong chương
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 5: Năng lượng hóa học có đáp án (2449 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 7: Nguyên tố nhóm VIIA (Nhóm halogen) có đáp án (1861 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 3: Liên kết hóa học có đáp án (1189 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 4: Phản ứng oxi hóa - khử có đáp án (1097 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 1: Cấu tạo nguyên tử có đáp án (1069 lượt thi)
- Trắc nghiệm tổng hợp Hóa 10 Chủ đề 2: Bảng tuần hoàn các nguyên tố hóa học có đáp án (1002 lượt thi)
