Câu hỏi:
21/07/2024 520
Cho phản ứng đơn giản xảy ra trong bình kín:
3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 không đổi và nồng độ N2 tăng 2 lần?
Cho phản ứng đơn giản xảy ra trong bình kín:
3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 không đổi và nồng độ N2 tăng 2 lần?
A. Tăng 2 lần.
A. Tăng 2 lần.
B. Tăng 4 lần.
B. Tăng 4 lần.
C. Tăng 8 lần.
C. Tăng 8 lần.
D. Tăng 6 lần.
D. Tăng 6 lần.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: A
Theo định luật tác dụng khối lượng: v=kC3H2CN2
Nếu nồng độ H2 không đổi và nồng độ N2 tăng lên 2 lần, ta có:
v′=k(C3H2)(2.CN2)=2⋅kC3H2CN2=2v.
Vậy tốc độ phản ứng tăng 2 lần.
Đáp án đúng là: A
Theo định luật tác dụng khối lượng: v=kC3H2CN2
Nếu nồng độ H2 không đổi và nồng độ N2 tăng lên 2 lần, ta có:
v′=k(C3H2)(2.CN2)=2⋅kC3H2CN2=2v.
Vậy tốc độ phản ứng tăng 2 lần.
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 2:
Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
Câu 4:
Thực hiện 2 thí nghiệm theo hình vẽ sau.
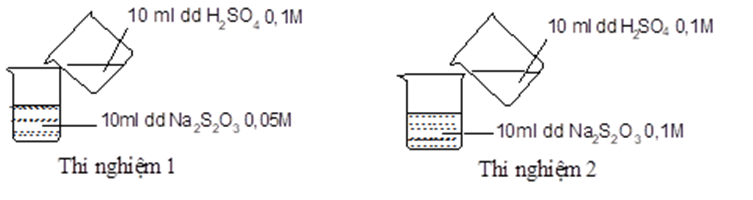
Ở thí nghiệm nào xuất hiện kết tủa trước?
Thực hiện 2 thí nghiệm theo hình vẽ sau.

Ở thí nghiệm nào xuất hiện kết tủa trước?
Câu 5:
Nếu chia một vật thành nhiều phẩn nhỏ hơn thì tổng diện tích bề mặt sẽ
Nếu chia một vật thành nhiều phẩn nhỏ hơn thì tổng diện tích bề mặt sẽ
Câu 6:
Phản ứng của H2 và I2 là phản ứng đơn giản:
H2 (g) + I2 (g) → 2HI (g)
Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là
Phản ứng của H2 và I2 là phản ứng đơn giản:
H2 (g) + I2 (g) → 2HI (g)
Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là
Câu 9:
Hình ảnh dưới đây minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng:
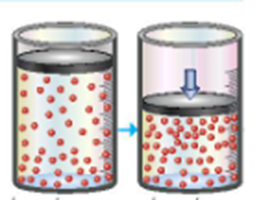
Hình ảnh dưới đây minh họa ảnh hưởng của yếu tố nào tới tốc độ phản ứng:

Câu 10:
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
Câu 11:
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
Câu 13:
Cho phương trình phản ứng tổng quát sau:
2A + B → C
Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức:
v=kC2ACB
Hằng số tốc độ k phụ thuộc vào yếu tố nào sau đây?
Cho phương trình phản ứng tổng quát sau:
2A + B → C
Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức:
v=kC2ACB
Hằng số tốc độ k phụ thuộc vào yếu tố nào sau đây?Câu 14:
Cho các phản ứng sau:
(1) Phản ứng than cháy trong không khí.
(2) Phản ứng tạo gỉ sắt.
(3) Phản ứng nổ của khí bình gas.
(4) Phản ứng lên men rượu.
Phản ứng xảy ra với tốc độ nhanh nhất là
Cho các phản ứng sau:
(1) Phản ứng than cháy trong không khí.
(2) Phản ứng tạo gỉ sắt.
(3) Phản ứng nổ của khí bình gas.
(4) Phản ứng lên men rượu.
Phản ứng xảy ra với tốc độ nhanh nhất là


