Trắc nghiệm Bài 7: Nitơ
-
624 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
03/12/2024 Xem đáp án
Xem đáp án
Đáp án đúng là : C
- Trong công nghiệp, nitơ được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng.
Đây là phương pháp tách nitơ từ không khí dựa trên sự khác biệt về nhiệt độ sôi của các thành phần trong không khí.
+ Nén và làm lạnh không khí:
Không khí được nén lại ở áp suất cao và sau đó làm lạnh sâu để chuyển thành trạng thái lỏng. Quá trình này làm giảm nhiệt độ của không khí xuống khoảng -200°C, tại đó không khí chuyển thành dạng lỏng.
+ Loại bỏ tạp chất:
Trước khi làm lạnh, không khí được loại bỏ các tạp chất như hơi nước (H₂O), carbon dioxide (CO₂) vì chúng có thể đóng băng và gây tắc nghẽn thiết bị.
+ Chưng cất phân đoạn:
Không khí lỏng được đưa vào tháp chưng cất phân đoạn.
Ở đây, nhờ sự khác biệt về nhiệt độ sôi:
Nitơ (N₂) có nhiệt độ sôi thấp hơn (-196°C) sẽ bay hơi trước.
Oxy (O₂) có nhiệt độ sôi cao hơn (-183°C) sẽ hóa lỏng và tách ra.
Các khí hiếm như argon (Ar) cũng được tách ra trong quá trình này.
+ Thu hồi nitơ:
Khí nitơ được thu hồi ở phần trên của tháp chưng cất và được nén lại để lưu trữ hoặc sử dụng trong các ứng dụng công nghiệp.
→ C đúng.A,B,D sai.
* Vị trí và cấu hình electron nguyên tử

- Nitơ (nitrogen) ở ô thứ 7, nhóm VA, chu kì 2 của bảng tuần hoàn.
- Cấu hình electron nguyên tử của nitơ là 1s22s22p3.
⇒ Ba electron ở phân lớp 2p có thể tạo được ba liên kết cộng hóa trị với các nguyên tử khác.
- Phân tử nitơ gồm hai nguyên tử, giữa chúng hình thành một liên kết ba: N ≡ N .
II. Tính chất vật lí
- Ở điều kiện thường, nitơ là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -196 oC.
- Khí nitơ tan rất ít trong nước.
- Nitơ không duy trì sự cháy và sự hô hấp.
III. Tính chất hóa học
- Liên kết ba trong phân tử nitơ rất bền.
⇒ Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học.
- Ở nhiệt độ cao, nitơ có thể tác dụng được với nhiều chất.
- Khi tham gia phản ứng oxi hóa - khử, số oxi hóa của nitơ có thể giảm hoặc tăng, do đó nó thể hiện tính oxi hóa hoặc tính khử.
- Tính oxi hóa vẫn là tính chất chủ yếu của nitơ.
1. Tính oxi hóa
Trong phản ứng với kim loại và hiđro, số oxi hóa của nguyên tố nitơ giảm từ 0 đến -3, nitơ thể hiện tính oxi hóa
a. Tác dụng với kim loại
- Ở nhiệt độ cao, nitơ tác dụng được với một số kim loại hoạt động như Ca, Mg, Al,... tạo thành nitrua kim loại.
b. Tác dụng với hiđro
- Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác, nitơ tác dụng trực tiếp với hiđro, tạo ra khí amoniac.
2. Tính khử
Ở nhiệt độ khoảng 3000oC (hoặc nhiệt độ của lò hồ quang điện), nitơ kết hợp trực tiếp với oxi, tạo ra khí nitơ monooxit NO.
- Trong thiên nhiên, khí NO được tạo thành khi có sấm sét.
- Ở điều kiện thường, khí NO không màu kết hợp ngay với oxi của không khí, tạo ra khí nitơ đioxit NO2 màu nâu đỏ.
IV. Ứng dụng
- Nguyên tố nitơ là một trong những thành phần dinh dưỡng chính của thực vật.
- Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để tổng hợp khí amoniac, từ đó sản xuất ra axit nitric, phân đạm, ...
- Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử, ... sử dụng nitơ làm môi trường trơ. Nitơ lỏng được dùng để bảo quản máu và các mẫu vật sinh học khác.
Xem thêm các bài viết liên quan,chi tiết khác:
Câu 2:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Trong phòng thí nghiệm, điều chế 1 lượng nhỏ nitơ tinh khiết bằng cách đun nóng nhẹ dung dịch bão hòa muối amoni nitrit:
NH4NO2 N2↑ + 2H2O
Câu 3:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Sản xuất phân lân là ứng dụng của axit H3PO4.
Câu 4:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phương trình hóa học:
N2 + 3H2
Xét hỗn hợp X
→ Hiệu suất tính theo N2.
Giả sử nX = 5 mol →
hản ứng = x mol →phản ứng = 3x mol;
→
Câu 5:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
NH4NO2 N2 + 2H2O.
Câu 6:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Nitơ nằm ở ô 7, chu kì 2, nhóm VA trong bảng tuần hoàn.
Câu 7:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Các nguyên tố thuộc nhóm VA trong bảng tuần hoàn: N, P, As, Sb,…
Câu 8:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Nguyên tử nitơ có 7 electron
→ Cấu hình electron:
Câu 9:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Phân tử nitơ gồm hai nguyên tử liên kết với nhau bởi một liên kết ba. Mà liên kết ba thì rất bền, ở 3000 chưa phân hủy rõ rệt thành các nguyên tử.
→ Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học.
Câu 10:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phản ứng của nitơ với oxi thì nitơ đóng vai trò là chất khử.
+ O2
Câu 11:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Nitơ phản ứng được với một số loại kim mạnh, H2 và O2.
2Al + N2 2AlN
N2 + 3H2 2NH3
N2 + 3Mg Mg3N2
Câu 12:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Trước phản ứng: [H2] = 1M, [N2] = 1M
Sau phản ứng: [NH3] = 0,4M
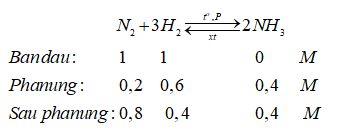
Câu 13:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
NaNO2 + NH4Cl N2↑ + NaCl + 2H2O
Câu 14:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
N2 + O2 2NO
Câu 15:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án B
+ O2 2
Trong phản ứng này, số oxi hóa của N tăng từ 0 lên +2 → N2 đóng vai trò là chất khử.
Câu 16:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
N2 + 3Mg Mg3N2
→phản ứng = 1- 0,95 = 0,05 mol
→ nMg = 3phản ứng = 0,15 mol
% Mg phản ứng =
Câu 17:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
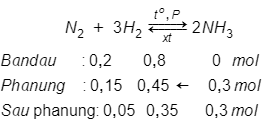
Nhận thấy: → Hiệu suất tính theo N2
→
Câu 18:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án là B
Không khí chứa 78,1% thể tích là N2, oxi chiếm 20,9% thể tích, 1% là hơi nước và các khí khác.
Câu 19:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phản ứng nhiệt phân: NH4NO2 N2 + 2H2O.
→
lít
Câu 20:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Trong phòng thí nghiệm, điều chế 1 lượng nhỏ nitơ tinh khiết bằng cách đun nóng nhẹ dung dịch bão hòa muối amoni nitrit:
NH4NO2 N2↑ + 2H2O
Câu 21:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Khí NO không màu hóa nâu ngay ngoài không khí.
2NO + O2 → 2NO2
Câu 22:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
N2 công thức cấu tạo là : N≡N N có cộng hóa trị là 3
N2 là đơn chất N có số oxi hóa là 0
Câu 23:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Li có thể tác dụng với khí N2 ở nhiệt độ thường.
3Li + N2 → 2Li3N
Câu 24:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Giả sử VA = 10 lít → VB = 6 lít
→ lít và lít
→
→ x = 2 lít
Do tỉ lệ thể tích của N2 và H2 là 1:3 → hiệu suất tính theo khí nào cũng được.
Câu 25:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Trong công nghiệp, khí N2 được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng.
Câu 26:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
N2 + 3H2 2NH3
Phản ứng điều chế NH3 là phản ứng thuận nghịch và tỏa nhiệt.
→ Tuân thủ theo nguyên lí Lơ Sa-tơ-li-ê
→ Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu tăng áp suất, giảm nhiệt độ.
Thực tế, thì điều kiện được áp dụng trong công nghiệp:
– Nhiệt độ: 450 – 500 Ở nhiệt độ thấp hơn, cân bằng hoá học trên chuyển dịch sang phải làm tăng hiệu suất phản ứng, nhưng lại làm giảm tốc độ phản ứng.
– Áp suất cao, từ 200 đến 300 atm.
– Chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O,…
Câu 27:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học do phân tử nitơ có liên kết ba khá bền.
Câu 28:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
N2 + O2 2NO
2NO + O2 → 2NO2
Câu 29:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Để loại bỏ các khí HCl, Cl2, CO2 và SO2 có lẫn trong khí N2 người ta sử dụng lượng dư dung dịch Ca(OH)2 vì các tạp chất khí tác dụng với Ca(OH)2 bị giữ lại trong dung dịch, N2 không phản ứng sẽ thoát ra.
2HCl + Ca(OH)2 → CaCl2 + 2H2O
4Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Câu 30:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Nitơ có số oxi hóa âm trong hợp chất với nguyên tố H ().
Có thể bạn quan tâm
- Trắc nghiệm Nitơ (có đáp án) (623 lượt thi)
- 15 câu trắc nghiệm Nitơ cực hay có đáp án (380 lượt thi)
- Trắc nghiệm Nitơ có đáp án (Nhận biết) (400 lượt thi)
- Trắc nghiệm Nitơ có đáp án (Thông hiểu) (360 lượt thi)
- Trắc nghiệm Nitơ có đáp án (Vận dụng) (310 lượt thi)
Các bài thi hot trong chương
- 100 câu trắc nghiệm Nito - Photpho nâng cao (1920 lượt thi)
- Trắc nghiệm Amoniac và muối amoni có đáp án (Thông hiểu) (1280 lượt thi)
- 100 câu trắc nghiệm Nito - Photpho cơ bản (1147 lượt thi)
- Trắc nghiệm Amoniac và muối amoni có đáp án (Nhận biết) (571 lượt thi)
- Trắc nghiệm Axit nitric và muối nitrat có đáp án (Nhận biết) (535 lượt thi)
- Trắc nghiệm Phân bón hóa học (có đáp án) Hóa học lớp 11 (513 lượt thi)
- Trắc nghiệm Axit nitric và muối nitrat (có đáp án) (507 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất hóa học của nitơ, photpho và hợp chất của chúng (có đáp án) (463 lượt thi)
- Trắc nghiệm Axit photphoric và muối photphat (có đáp án) (413 lượt thi)
- Trắc nghiệm Photpho (có đáp án) (406 lượt thi)
