Giáo án KHTN 7 Bài 5 (Cánh diều 2024): Giới thiệu về liên kết hóa học | Khoa học tự nhiên 7
Với Giáo án Bài 5: Giới thiệu về liên kết hóa học Khoa học tự nhiên lớp 7 sách Cánh diều sẽ giúp thầy cô dễ dàng giảng dạy và biên soạn giáo án KHTN 7 Bài 5.
Chỉ từ 400k mua trọn bộ Giáo án KHTN 7 Cánh diều bản word trình bày đẹp mắt (Chỉ 30k cho 1 bài giảng bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Giáo án KHTN 7 Bài 5 (Cánh diều): Giới thiệu về liên kết hóa học (6 tiết)
I. MỤC TIÊU
1. Kiến thức
- Nêu được mô hình sắp xếp electron trong vỏ nguyên tử của một số nguyên tố khí hiếm.
- Nêu được sự hình thành liên kết ion theo nguyên tắc cho và nhận electron để tạo ra ion có lớp electron ngoài cùng của nguyên tử nguyên tố khí hiếm (áp dụng cho các phân tử đơn giản như sodium chloride, magnesium oxide…).
- Nêu được sự hình thành liên kết cộng hóa trị theo nguyên tắc dùng chung electron để tạo ra lớp electron ngoài cùng của nguyên tử nguyên tố khí hiếm (ammonia, nước, carbon dioxide, nitrogen …).
- Chỉ ra được sự khác nhau về một số tính chất của chất ion và chất cộng hóa trị.
2. Năng lực
2.1. Năng lực chung
- Năng lực tự chủ và tự học: tìm kiếm thông tin, đọc sách giáo khoa, quan sát tranh ảnh để tìm hiểu về liên kết ion, liên kết cộng hóa trị và tính chất của chất ion, chất cộng hóa trị.
- Năng lực giao tiếp và hợp tác: thảo luận nhóm trong tìm hiểu về sự tạo thành liên kết trong một số phân tử.
- Năng lực giải quyết vấn đề và sáng tạo: giải quyết vấn đề trong lập bảng so sánh tính chất của chất ion và chất cộng hóa trị, giải thích hiện tượng thường gặp trong đời sống.
2.2. Năng lực khoa học tự nhiên
- Quan sát được tranh, ảnh và thu thập thông tin từ hiện tượng thực tế để rút ra khái niệm liên kết ion, liên kết cộng hóa trị, tính chất của chất ion, chất cộng hóa trị.
- So sánh, rút ra được đặc điểm khác nhau về một số tính chất của chất ion và chất cộng hóa trị.
3. Phẩm chất
- Chăm học, chịu khó tìm tòi tài liệu và thực hiện các nhiệm vụ cá nhân nhằm tìm hiểu về liên kết hóa học.
- Có trách nhiệm trong hoạt động nhóm, chủ động nhận và thực hiện nhiệm vụ nhóm.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên
- Các tranh phóng to các ảnh trong SGK (hoặc hình ảnh rõ nét để chiếu lên màn chiếu).
- Thiết kế phiếu học tập.
2. Học sinh
- Ôn tập bài cũ và chuẩn bị bài mới.
III. TIẾN TRÌNH DẠY HỌC
1. Hoạt động 1. Mở đầu
a) Mục tiêu
- Tạo hứng thú và huy động kiến thức của HS về liên kết hóa học.
b) Nội dung
- HS làm việc cá nhân, suy nghĩ trả lời câu hỏi: Hãy dự đoán và trình bày sự hình thành liên kết giữa các nguyên tử F trong phân tử F2.
c) Sản phẩm
Dự đoán của HS:
- Nguyên tử F có xu hướng nhận thêm 1 electron để lớp vỏ có 8 electron giống nguyên tử khí hiếm.
- 2 nguyên tử F liên kết với nhau để mỗi nguyên tử có 8 electron ở lớp vỏ.
- …
Các dự đoán của HS có thể đúng hoặc sai, GV không nhận xét mà dựa vào đó để đặt vấn đề vào bài mới.
d) Tổ chức thực hiện
- GV giao nhiệm vụ: Yêu cầu HS quan sát hình ảnh mở đầu bài học và trả lời câu hỏi: Hãy dự đoán và trình bày sự hình thành liên kết giữa các nguyên tử F trong phân tử F2.
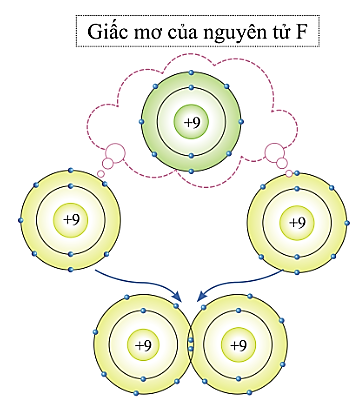
- HS đọc SGK, quan sát hình, suy nghĩ cá nhân đưa ra dự đoán.
- HS đưa ra các dự đoán.
- GV nhận xét, đưa vấn đề: Vậy để kiếm chứng các dự đoán của các em, dự đoán nào đúng chúng ta sẽ cùng đi vào tìm hiểu bài học ngày hôm nay: Bài 5 – Giới thiệu về liên kết hoá học.
2. Hoạt động 2. Hình thành kiến thức
2.1. Tìm hiểu đặc điểm cấu tạo vỏ nguyên tử khí hiếm
a) Mục tiêu
- Nêu được mô hình sắp xếp electron trong vỏ nguyên tử của một số nguyên tố khí hiếm.
b) Nội dung
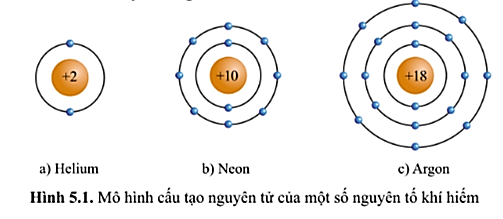
- HS quan sát mô hình cấu tạo vỏ nguyên tử của một số khí hiếm (hình 5.1 – SGK) và nhận xét số electron ở lớp ngoài cùng của vỏ nguyên tử.
c) Sản phẩm
- Câu trả lời của HS, dự kiến:
Hình 5.1a) nguyên tử helium có 2 electron lớp ngoài cùng.
Hình 5.1b) nguyên tử neon có 8 electron lớp ngoài cùng.
Hình 5.1c) nguyên tử argon có 8 electron lớp ngoài cùng.
⇒ Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron).
d) Tổ chức thực hiện
|
Hoạt động của giáo viên và học sinh |
Nội dung |
|
*Chuyển giao nhiệm vụ học tập - GV yêu cầu HS quan sát hình 5.1 SGK - 33, trả lời câu hỏi 1. - HS nhận nhiệm vụ. * Thực hiện nhiệm vụ - HS làm việc cá nhân, quan sát hình, đếm số electron trên lớp vỏ của 3 nguyên tử khí hiếm và nêu nhận xét. - GV theo dõi và đôn đốc HS thực hiện nhiệm vụ. * Báo cáo kết quả - Đại diện 1 số HS trả lời, HS khác nhận xét. * Kết luận - GV chốt kiến thức: Lớp vỏ ngoài cùng của nguyên tử khí hiếm có 8 electron (riêng He có 2 electron), là lớp vỏ bền vững. |
I. Đặc điểm cấu tạo vỏ nguyên tử khí hiếm - Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững. - Các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường. - Nguyên tử nguyên tố khác có lớp vỏ ngoài cùng kém bền, có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác. |
………………………………………….
………………………………………….
………………………………………….
Tài liệu có 17 trang, trên đây là tóm tắt 4 trang đầu của Giáo án Khoa học tự nhiên 7 Bài 5 Cánh diều.
Để mua Giáo án KHTN 7 Cánh diều năm 2024 mới nhất, mời Thầy/Cô liên hệ:
Tài liệu có đáp án, ấn vào đây!
Xem thêm giáo án Khoa học tự nhiên 7 sách Cánh diều hay, chi tiết khác:
Giáo án Bài 2: Nguyên tố hóa học
Giáo án Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Xem thêm các chương trình khác:
- Giáo án PPT Ngữ văn 7 Kết nối tri thức
- Giáo án PPT Toán 7 Kết nối tri thức
- Giáo án Ngữ văn 7 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Tiếng Anh 7 Global success năm 2024 (mới nhất)
- Giáo án Toán 7 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Khoa học tự nhiên 7 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Lịch sử 7 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Địa lí 7 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Tin học 7 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Công nghệ 7 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Hoạt động trải nghiệm 7 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án PPT Khoa học tự nhiên 7 Kết nối tri thức
- Giáo án Ngữ văn 7 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Tiếng Anh 7 Friends plus năm 2024 (mới nhất)
- Giáo án Toán 7 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Khoa học tự nhiên 7 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Lịch sử 7 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Địa lí 7 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Tin học 7 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Công nghệ 7 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án PPT Toán 7 Chân trời sáng tạo
- Giáo án Hoạt động trải nghiệm 7 Chân trời sáng tạo năm 2024 (mới nhất)
