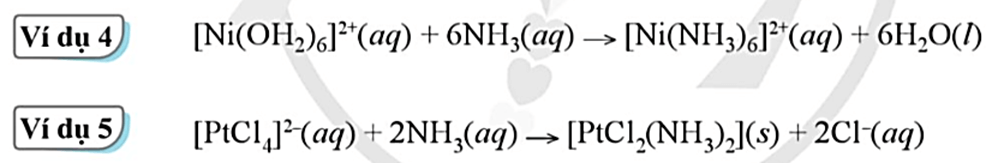Giải Hóa 12 Bài 22 (Cánh diều): Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
Với giải bài tập Hóa 12 Bài 22: Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 12 Bài 22.
Giải Hóa 12 Bài 22: Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch
Mở đầu trang 146 Hóa học 12: Muối copper(II) sulfate (CuSO4) có màu trắng. Dung dịch copper(II) sulfate có màu xanh.
Hãy dự đoán hiện tượng xảy ra khi thêm từ từ cho đến dư dung dịch ammonia vào ống nghiệm chứa dung dịch copper(II) sulfate. Giải thích.
Lời giải:
Hiện tượng: Xuất hiện kết tủa màu xanh nhạt, lượng kết tủa tăng dần đến không đổi. Sau đó, kết tủa tan dần đến hết, dung dịch từ màu xanh nhạt chuyển sang màu xanh lam.
Giải thích:
- Dung dịch copper(II) sulfate có màu xanh do Cu2+ tạo phức chất aqua với nước.
Cu2+(aq) + 6H2O(l) ⟶ [Cu(OH2)6]2+(aq)
- Thêm vài giọt dung dịch ammonia (NH3) có môi trường kiềm.
NH3 + H2O ⇌ + OH−
Khi đó ion OH− thay thế phối tử H2O trong [Cu(OH2)6]2+(aq) tạo kết tủa [Cu(OH)2(OH2)4] có màu xanh nhạt.
- Khi lượng [Cu(OH2)6]2+(aq) hết, kết tủa [Cu(OH)2(OH2)4] đạt đến cực đại. NH3 dư tiếp tục thay thế phối tử OH− và H2O trong [Cu(OH)2(OH2)4] làm cho kết tủa tan dần và hình thành phức chất [Cu(NH3)4(OH2)2]2+(aq) có màu xanh lam.
Luyện tập trang 147 Hóa học 12: Phức chất aqua có dạng hình học bát diện được hình thành khi cho CrCl3 vào nước. Viết phương trình hoá học của quá trình tạo phức chất trên.
Lời giải:
Phức chất aqua có dạng hình học bát diện được hình thành khi cho CrCl3 vào nước tức là nguyên tử trung tâm Cr3+ tạo 6 liên kết σ với 6 phân tử nước.
Phương trình hoá học của quá trình tạo phức khi cho CrCl3 vào nước:
CrCl3(aq) + 6H2O(l) ⟶ [Cr(OH2)6]Cl3(aq)
Hay Cr3+(aq) + 6H2O(l) ⟶ [Cr(OH2)6]3+(aq)
Câu hỏi trang 148 Hóa học 12: Trong Ví dụ 4 và Ví dụ 5, hãy cho biết:
a) Phối tử thay thế và phối tử bị thay thế.
b) Dấu hiệu của phản ứng tạo phức chất có thể là gì?
Lời giải:
Trong Ví dụ 4:
a) Phối tử thay thế là NH3, phối tử bị thay thế là H2O
b) Dấu hiệu của phản ứng tạo phức chất là sự biến đổi màu của dung dịch.
Trong Ví dụ 5:
a) Phối tử thay thế là NH3, phối tử bị thay thế là Cl-
b) Dấu hiệu của phản ứng tạo phức chất là sự tạo kết tủa.
Thí nghiệm 1 trang 148 Hóa học 12: Phản ứng copper(II) sulfate với dung dịch ammonia
Chuẩn bị:
- Hóa chất: Dung dịch CuSO4 2%, dung dịch NH3 khoảng 10%.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Cho từ từ từng giọt dung dịch NH3 vào ống nghiệm chứa 5 mL dung dịch CuSO4. Lắc ống nghiệm trong quá trình thêm dung dịch NH3. Khi dung dịch trong ống nghiệm chuyển sang màu xanh lam thì dừng thêm dung dịch NH3.
Yêu cầu: Quan sát và giải thích hiện tượng. Viết phương trình hóa học của phản ứng xảy ra.
Lời giải:
Hiện tượng: Xuất hiện kết tủa màu xanh nhạt, lượng kết tủa tăng dần đến không đổi. Sau đó, kết tủa tan dần đến hết, dung dịch từ màu xanh nhạt chuyển sang màu xanh lam.
Giải thích:
- Thêm vài giọt dung dịch ammonia (NH3) có môi trường kiềm.
NH3 + H2O ⟶ + OH−
Khi đó ion OH− thay thế phối tử H2O trong [Cu(OH2)6]2+(aq) tạo kết tủa [Cu(OH)2(OH2)4] có màu xanh nhạt.
- Khi lượng [Cu(OH2)6]2+(aq) hết, kết tủa [Cu(OH)2(OH2)4] đạt đến cực đại. NH3 dư tiếp tục thay thế phối tử OH− và H2O trong [Cu(OH)2(OH2)4] làm cho kết tủa tan dần và hình thành phức chất [Cu(NH3)4(OH2)2]2+(aq) có màu xanh lam.
Phương trình hóa học:
[Cu(OH2)6]2+(aq) + 2OH−(aq) ⟶ [Cu(OH)2(OH2)4](s) + 2H2O(l)
[Cu(OH)2(OH2)4](s) + 4NH3(aq) ⟶ [Cu(NH3)4(OH2)2]2+(aq) + 2OH−(aq) + 2H2O(l)
Thí nghiệm 2 trang 149 Hóa học 12: Khả năng phản ứng của dung dịch copper(II) sulfate loãng với hydrochloric acid đặc
Chuẩn bị:
- Hóa chất: Dung dịch CuSO4 0,5%, dung dịch HCl đặc.
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt.
Tiến hành: Thêm khoảng 2 mL dung dịch HCl vào ống nghiệm chứa khoảng 1 mL dung dịch CuSO4.
Yêu cầu: Quan sát và giải thích hiện tượng. Viết phương trình hóa học của phản ứng xảy ra.
Lời giải:
Hiện tượng: Màu xanh của dung dịch chuyển sang màu vàng.
Giải thích: Do ion Cl− thay thế phối tử H2O trong phức aqua của Cu2+
Phương trình hóa học:
Cu2+(aq) + 6H2O(l) ⟶ [Cu(OH2)6]2+(aq)
[Cu(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CuCl4]2−(aq) + 6H2O(l)
Vận dụng trang 149 Hóa học 12: Tìm hiểu và giải thích ứng dụng trong hóa học của phức chất [Cu(NH3)4(OH2)2]2+.
Lời giải:
Ứng dụng trong hóa học của phức chất [Cu(NH3)4(OH2)2]2+:
- Xác định sự có mặt hàm lượng cation Cu2+ trong dung dịch dựa vào phản ứng tạo phức chất [Cu(NH3)4(OH2)2]2+ có màu xanh lam.
- Dùng để tinh chế và phân tích trọng lượng phân tử của cellulose do có khả năng hòa tan cellulose.
- Làm chất tạo màu, thuốc nhuộm vải do có màu xanh lam đặc trưng.
Bài tập
Bài 1 trang 150 Hóa học 12: Hoàn thành phản ứng dưới đây:
NiCl2(s) + ? ⟶ [Ni(OH2)6]2+(aq) + ?
Lời giải:
NiCl2(s) + 6H2O(l) ⟶ [Ni(OH2)6]2+(aq) + 2Cl−(aq)
Bài 2 trang 150 Hóa học 12: Trong phản ứng thuận nghịch dưới đây, việc tăng nồng độ Cl−(aq) ảnh hưởng như thế nào đến sự thay đổi màu của dung dịch?
[Cu(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CuCl4]2−(aq) + 6H2O(l)
Màu xanh Màu vàng
Lời giải:
Khi tăng nồng độ Cl−(aq), cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ Cl−(aq), tức là chiều tạo phức [CuCl4]2−(aq).
Do đó việc tăng nồng độ Cl−(aq) làm cho màu vàng của dung dịch trở lên đậm hơn.
Bài 3 trang 150 Hóa học 12: Phản ứng nào dưới đây là phản ứng thay thế phối tử trong phức chất?
a) [Co(OH2)6]3+(aq) + 6NH3(aq) ⟶ [Co(NH3)6]3+(aq) + 6H2O(l)
b) 2Na[Au(CN)2](aq) + Zn(s) ⟶ Na2[Zn(CN)4](aq) + 2Au(s)
c) [Co(OH2)6]2+(aq) + 4Cl−(aq) ⇌ [CoCl4]2−(aq) + 6H2O(l)
Lời giải:
Phản ứng thay thế phối tử trong phức chất là:
a) Phối tử NH3 thay thế cho phối tử H2O trong phức chất.
c) Phối tử Cl− thay thế cho phối tử H2O trong phức chất.
Còn phản ứng b là phản ứng thay thế nguyên tử trung tâm Au bằng Zn.
Xem thêm các chương trình khác:
- Soạn văn 12 Cánh diều (hay nhất)
- Văn mẫu 12 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 12 – Cánh diều
- Tác giả tác phẩm Ngữ văn 12 - Cánh diều
- Bố cục tác phẩm Ngữ văn 12 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 12 – Cánh diều
- Giải sgk Toán 12 – Cánh diều
- Giải Chuyên đề học tập Toán 12 – Cánh diều
- Lý thuyết Toán 12 – Cánh diều
- Giải sbt Toán 12 – Cánh diều
- Giải sgk Tiếng Anh 12 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 12 – iLearn Smart World
- Giải sgk Vật lí 12 – Cánh diều
- Giải Chuyên đề học tập Vật lí 12 – Cánh diều
- Lý thuyết Vật lí 12 – Cánh diều
- Giải sbt Vật lí 12 – Cánh diều
- Giải sgk Sinh học 12 – Cánh diều
- Giải Chuyên đề học tập Sinh học 12 – Cánh diều
- Lý thuyết Sinh học 12 – Cánh diều
- Giải sbt Sinh học 12 – Cánh diều
- Giải sgk Lịch sử 12 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 12 – Cánh diều
- Giải sbt Lịch sử 12 – Cánh diều
- Giải sgk Địa lí 12 – Cánh diều
- Giải Chuyên đề học tập Địa lí 12 – Cánh diều
- Giải sbt Địa lí 12 – Cánh diều
- Giải sgk Tin học 12 – Cánh diều
- Giải Chuyên đề học tập Tin học 12 – Cánh diều
- Giải sbt Tin học 12 – Cánh diều
- Lý thuyết Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 – Cánh diều
- Giải sgk Kinh tế pháp luật 12 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Cánh diều
- Giải sbt Kinh tế pháp luật 12 – Cánh diều
- Giải sgk Giáo dục quốc phòng 12 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 – Cánh diều