Giải Hóa 12 Bài 14 (Cánh diều): Tính chất hoá học của kim loại
Với giải bài tập Hóa 12 Bài 14: Tính chất hoá học của kim loại sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 12 Bài 14.
Giải Hóa 12 Bài 14: Tính chất hoá học của kim loại
Mở đầu trang 95 Hóa học 12: Ở nhiệt độ thường, những kim loại nào có thể phản ứng được với dung dịch HCl 1 M, những kim loại nào có thể phản ứng được với H2O để tạo ra H2? Giải thích.
Lời giải:
Ở nhiệt độ thường:
- Những kim loại có thể phản ứng được với dung dịch HCl 1 M là: Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb…
- Những kim loại có thể phản ứng được với H2O để tạo ra H2 là: Li, K, Ba, Ca, Na…
Giải thích:
- Trong môi trường trung tính, có:
2H2O + 2e ⇌ H2 + 2OH- với = – 0,413 V
Cặp oxi hóa – khử Mn+/M của các kim loại Li, K, Ba, Ca, Na có giá trị thế điện cực chuẩn nhỏ hơn – 0,413 V nên các kim loại đó có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen.
- Trong môi trường acid, có:
2H+ + 2e ⟶ H2 với = 0 V
Cặp oxi hóa – khử Mn+/M của các kim loại Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb có thế điện cực chuẩn nhỏ hơn 0 V có thể khử được ion H+ trong dung dịch acid tạo thành khí H2.
Cần nhớ:
- Mg phản ứng rất chậm với nước ở nhiệt độ thường, phản ứng nhanh hơn khi đun nóng.
- Al tác dụng được với nước. Tuy nhiên, phản ứng nhanh chóng dừng lại vì sản phẩm hydroxide không tan ngăn cản nhôm phản ứng với nước.
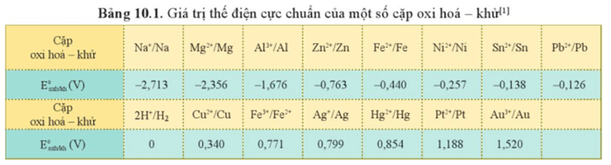
Câu hỏi 1 trang 95 Hóa học 12: Dựa vào Bảng 10.1, hãy sắp xếp các kim loại sau đây theo chiều giảm dần tính khử: Al, Na, K, Fe, Cu.
Lời giải:
Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng yếu.
- Các kim loại được sắp xếp theo chiều giảm dần tính khử là: K, Na, Al, Fe, Cu.
Luyện tập 1 trang 96 Hóa học 12: Viết phương trình hóa học của phản ứng giữa kim loại kẽm với mỗi chất sau: oxygen, sulfur va chlorine.
Lời giải:
2Zn(s) + O2 (g) 2ZnO(s)
Zn(s) + S (s) ZnS(s)
Zn(s) + Cl2 (g) ZnCl2(s)
Thí nghiệm 1 trang 96 Hóa học 12: Kim loại tác dụng với oxygen trong không khí
Chuẩn bị:
- Hoá chất: Băng magnesium dài khoảng 3 cm - 5 cm.
- Dụng cụ: Đèn cồn, bật lửa, kẹp đốt hoá chất.
Tiến hành: Dùng kẹp đốt hoá chất đưa đoạn băng magnesium vào ngọn lửa đèn cồn.
Yêu cầu: Quan sát và giải thích hiện tượng, viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
- Hiện tượng: Phản ứng xảy ra mãnh liệt, tỏa nhiều nhiệt, phát ra ánh sáng chói và xuất hiện khói trắng.
- Giải thích: Khói trắng đó là magnesium oxide (MgO) sinh ra.
+ Phương trình hóa học:
2Mg(s) + O2 (g) 2MgO(s)
+ Sản phẩm thu được là chất rắn có màu trắng (MgO).
Luyện tập 2 trang 97 Hóa học 12: Cho = −2,925 V, = 0,854 V.
a) Cho biết vì sao potassium phản ứng được với nước. Viết phương trình hóa học của phản ứng xảy ra.
b) Giải thích vì sao thuỷ ngân không phản ứng được với nước để tạo hydroxide và khí hydrogen.
Lời giải:
- Trong môi trường trung tính, có:
2H2O + 2e ⇌ H2 + 2OH- với = – 0,413 V
a) Ta có = −2,925 V < –0,413 V nên potassium phản ứng được với nước.
2K(s) + 2H2O(l) ⟶ 2KOH(aq) + H2(g)
b) Ta có = 0,854 V > –0,413 V nên thuỷ ngân không phản ứng được với nước để tạo hydroxide và khí hydrogen.
Thí nghiệm 2 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch muối
Chuẩn bị:
- Hoá chất: Đinh sắt đã được đánh sạch bề mặt, dung dịch copper(II) sulfate 1 M.
- Dụng cụ: Cốc thuỷ tinh.
Tiến hành: Cho đinh sắt vào cốc thuỷ tinh chứa dung dịch copper(II) sulfate 1 M.
Yêu cầu: Sau khoảng 10 phút, quan sát, mô tả hiện tượng và giải thích.
Lời giải:
- Hiện tượng: Xuất hiện lớp chất rắn màu đỏ bám trên đinh sắt, màu xanh của dung dịch nhạt dần.
- Giải thích: Sản phẩm thu được là Cu ở thể rắn và có màu đỏ. CuSO4 đã tham gia phản ứng nên nồng độ giảm dần làm cho màu dung dịch nhạt dần đi.
+ Phương trình hóa học:
Fe(s) + CuSO4 (aq) ⟶ FeSO4 (aq)+ Cu(s)
+ Do = −0,44 V < = 0,34 V nên sắt dễ dàng đẩy đồng ra khỏi dung dịch copper(II) sulfate.
Thí nghiệm 3 trang 97 Hóa học 12: Phản ứng của kim loại với dung dịch hydrochloric acid
Chuẩn bị:
- Hoá chất: Lá đồng, băng magnesium, dung dịch hydrochloric acid 1 M.
- Dụng cụ: Ống nghiệm.
Tiến hành: Cho vào hai ống nghiệm mỗi ống khoảng 2 mL dung dịch HCl 1 M. Cho tiếp là đồng vào ống nghiệm (1), băng magnesium vào ống nghiệm (2).
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và viết phương trình hoá học của phản ứng.
Lời giải:
- Hiện tượng: Ở ống nghiệm (1) không có hiện tượng xảy ra. Ở ống nghiệm (2) thấy sủi bọt khí không màu, băng magnesium tan dần.
- Giải thích: Lá đồng không phản ứng với dung dịch hydrochloric acid. Băng magnesium phản ứng với dung dịch hydrochloric acid giải phóng khí hydrogen.
+ Phương trình hóa học:
Mg(s) + 2HCl (aq) ⟶ MgCl2 (aq)+ H2(g)
Thí nghiệm 4 trang 98 Hóa học 12: Phản ứng của kim loại với dung dịch sulfuric acid loãng, dung dịch sulfuric acid đặc, nóng
Chuẩn bị:
- Hoá chất: Lá đồng, dung dịch sulfuric acid 1 M, dung dịch sulfuric acid khoảng 70%, giấy quỳ.
- Dụng cụ: Ống nghiệm, kẹp ống nghiệm, bông tẩm nước, đèn cồn, bật lửa.
Tiến hành:
- Cho vào mỗi ống nghiệm chứa dung dịch sulfuric acid loãng và ống nghiệm chứa dung dịch sulfuric acid đặc một lá đồng.
- Đậy mỗi ống nghiệm bằng bông tẩm nước.
- Đun hai ống nghiệm trên ngọn lửa đèn cồn. Sau một thời gian, dùng mẫu giấy quỳ kiểm tra pH của bông tẩm nước đã dùng để nút hai ống nghiệm trên.
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích. Viết phương trình hoá học của phản ứng xảy ra (nếu có).
Chú ý: Cẩn thận khi sử dụng dung dịch sulfuric acid đặc.
Lời giải:
- Hiện tượng: Ở ống nghiệm chứa dung dịch sulfuric acid loãng không có hiện tượng xảy ra. Ở ống nghiệm chứa dung dịch sulfuric acid đặc thấy sủi bọt khí không màu, lá đồng tan dần, bông tẩm nước nút ống nghiệp làm giấy quỳ chuyển đỏ.
- Giải thích:
+ Lá đồng không phản ứng với dung dịch sulfuric acid loãng.
+ Lá đồng phản ứng với dung dịch sulfuric acid đặc nóng giải phóng khí sulfur dioxide. Khí này tan trong nước tạo dung dịch acid làm giấy quỳ chuyển đỏ.
+ Phương trình hóa học:
Cu(s) + 2H2SO4(aq) CuSO4(aq) + SO2(g) + 2H2O(l)
SO2(g)+ H2O(l) ⇌ H2SO3(aq)
Câu hỏi 2 trang 98 Hóa học 12: Dựa vào thế điện cực chuẩn của kim loại trong Bảng 10.1, giải thích vì sao Cu và Ag không phản ứng với dung dịch hydrochloric acid 1 M.
Lời giải:
Có = 0 V mà = 0,34 V > 0 V; = 0,799 V > 0 V nên Cu, Ag không khử được ion H+ trong dung dịch hydrochloric acid.
Do đó Cu và Ag không phản ứng với dung dịch hydrochloric acid 1 M.
Luyện tập 3 trang 98 Hóa học 12: Có thể dùng dung dịch sulfuric acid đặc để phân biệt đoạn dây bạc và đoạn dây platinum được không? Vì sao?
Lời giải:
Có thể dùng dung dịch sulfuric acid đặc để phân biệt đoạn dây bạc và đoạn dây platinum được.
Vì:
+ Bạc tác dụng được với dung dịch sulfuric acid đặc cho hiện tượng sủi bọt khí và dung dịch xuất hiện vẩn đục trắng.
2Ag(s)+ 2H2SO4(aq) Ag2SO4(s)+ SO2(g)+ 2H2O(l)
+ Platinum không tác dụng được với dung dịch sulfuric acid đặc nên không có hiện tượng xảy ra.
Bài tập
Bài 1 trang 99 Hóa học 12: Cho đinh sắt đã được đánh sạch bề mặt vào dung dịch của một trong các muối sau (có nồng độ 1 M): aluminium chloride, zinc nitrate, copper(II) sulfate, lead(II) nitrate.
a) Trường hợp nào có phản ứng tạo thành kim loại? Nêu vai trò của mỗi chất tham gia phản ứng.
b) Viết các phương trình hoá học của phản ứng ở dạng ion thu gọn.
Lời giải:
a) Ta có: = −0,44 V; = −1,676 V; = −0,763 V; = 0,34 V; = −0,126 V.
Như vậy sắt có thế điện cực chuẩn nhỏ hơn của đồng và chì.
Trường hợp có phản ứng tạo thành kim loại là:
+ Cho đinh sắt vào dung dịch copper(II) sulfate. Khi đó sắt (Fe) đóng vai trò là chất khử, copper(II) sulfate (CuSO4) đóng vai trò là chất oxi hóa.
+ Cho đinh sắt vào dung dịch lead(II) nitrate. Khi đó sắt (Fe) đóng vai trò là chất khử, lead(II) nitrate (Pb(NO3)2) đóng vai trò là chất oxi hóa.
b) Phương trình hoá học ở dạng ion thu gọn.
Fe(s) + Cu2+(aq) ⟶ Fe2+(aq) + Cu(s)
Fe(s) + Pb2+(aq) ⟶ Fe2+(aq) + Pb(s)
Bài 2 trang 99 Hóa học 12: Từ giá trị thế điện cực chuẩn của các cặp oxi hoá − khử ở Bảng 10.1 và giá trị = – 0,413 V ở môi trường trung tính, cho biết phản ứng nào sau đây có thể xảy ra. Viết phương trình hoá học của phản ứng (nếu có).
a) Ag(s) + Cu2+ (aq) →
b) Sn(s) + Cu2+ (aq) →
c) Ni(s) + H₂O(1) →
Lời giải:
Có:
= 0,799 V > = 0,34 V nên phản ứng a không xảy ra.
= −0,138 V < = 0,34 V nên phản ứng b xảy ra.
Sn(s) + Cu2+(aq) ⟶ Sn2+(aq) + Cu(s)
= −0,257 V > = – 0,413 V nên phản ứng c không xảy ra.
Bài 3 trang 99 Hóa học 12: Dựa vào tính chất vật lí và tính chất hoá học, giải thích vì sao bạc, vàng thường được dùng làm đồ trang sức.
Lời giải:
Bạc, vàng thường được dùng làm đồ trang sức vì:
+ Tính chất vật lí: kim loại có ánh kim, dễ uốn và dát mỏng. Do đó dễ dàng tạo hình đồ trang sức đa dạng theo ý muốn.
+ Tính chất hóa học: kim loại có giá trị thế điện cực chuẩn cao hay tính khử rất yếu, khó bị oxi hóa. Do đó đồ trang sức làm từ bạc, vàng bền đẹp với thời gian.
Xem thêm các chương trình khác:
- Soạn văn 12 Cánh diều (hay nhất)
- Văn mẫu 12 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 12 – Cánh diều
- Tác giả tác phẩm Ngữ văn 12 - Cánh diều
- Bố cục tác phẩm Ngữ văn 12 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 12 – Cánh diều
- Giải sgk Toán 12 – Cánh diều
- Giải Chuyên đề học tập Toán 12 – Cánh diều
- Lý thuyết Toán 12 – Cánh diều
- Giải sbt Toán 12 – Cánh diều
- Giải sgk Tiếng Anh 12 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 12 – iLearn Smart World
- Giải sgk Vật lí 12 – Cánh diều
- Giải Chuyên đề học tập Vật lí 12 – Cánh diều
- Lý thuyết Vật lí 12 – Cánh diều
- Giải sbt Vật lí 12 – Cánh diều
- Giải sgk Sinh học 12 – Cánh diều
- Giải Chuyên đề học tập Sinh học 12 – Cánh diều
- Lý thuyết Sinh học 12 – Cánh diều
- Giải sbt Sinh học 12 – Cánh diều
- Giải sgk Lịch sử 12 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 12 – Cánh diều
- Giải sbt Lịch sử 12 – Cánh diều
- Giải sgk Địa lí 12 – Cánh diều
- Giải Chuyên đề học tập Địa lí 12 – Cánh diều
- Giải sbt Địa lí 12 – Cánh diều
- Giải sgk Tin học 12 – Cánh diều
- Giải Chuyên đề học tập Tin học 12 – Cánh diều
- Giải sbt Tin học 12 – Cánh diều
- Lý thuyết Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 – Cánh diều
- Giải sgk Kinh tế pháp luật 12 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Cánh diều
- Giải sbt Kinh tế pháp luật 12 – Cánh diều
- Giải sgk Giáo dục quốc phòng 12 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 – Cánh diều