Giải Hóa 12 Bài 17 (Cánh diều): Nguyên tố nhóm IA
Với giải bài tập Hóa 12 Bài 17: Nguyên tố nhóm IA sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 12 Bài 17.
Giải Hóa 12 Bài 17: Nguyên tố nhóm IA
Mở đầu trang 113 Hóa học 12:
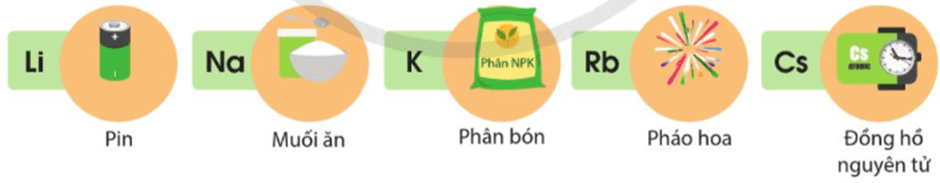
Hình 17.1. Một số ứng dụng của hợp chất của nguyên tố nhóm IA
Nguyên tố nhóm IA và một số hợp chất của chúng có nhiều ứng dụng trong thực tiễn (Hình 17.1).
a) Nêu một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IA mà em biết.
b) Kim loại nhóm IA có những tính chất vật lí và tính chất hoá học đặc trưng nào?
Lời giải:
a) Một số ứng dụng của đơn chất và hợp chất của nguyên tố nhóm IA:
Li: Nguyên liệu sản xuất pin.
NaCl: Muối ăn, chế biến và bảo quản thực phẩm, làm nguyên liệu chính của quy trình công nghiệp chlorine – kiềm.
NaOH: Dùng trong chế biến dầu mỏ, sản xuất nhôm, giấy, xà phòng và nhiều hóa chất khác.
NaHCO3:
- Điều chỉnh vị chua của nước giải khát.
- Làm tăng độ xốp của bánh và mềm thực phẩm.
Na2CO3:
- Dùng làm chất tẩy rửa dầu, mỡ.
- Làm mềm nước cứng, nguyên liệu sản xuất thủy tinh, giấy.
KNO3: Nguyên liệu sản xuất thuốc súng.
K2SO4: Sản xuất phân bón.
Các hợp chất của Rb được sử dụng trong pháo hoa.
Cs: được sử dụng trong các tế bào quang điện.
b)
- Tính chất vật lí đặc trưng của kim loại nhóm IA: Khối lượng riêng nhỏ và độ cứng thấp hơn nhiều so với các kim loại nhóm khác. Cấu trúc tinh thể khá rỗng (kiểu mạng tinh thể lập phương tâm khối) và có lực liên kết kim loại yếu. Do đó có thể cắt kim loại kiềm bằng dao, kéo.
- Tính chất hóa học đặc trưng của kim loại nhóm IA: Tính khử mạnh do giá trị rất nhỏ. M ⟶ M+ + e
Phản ứng mạnh với nước, oxygen, chlorine và nhiều chất oxi hóa khác, …
Câu hỏi 1 trang 114 Hóa học 12: Hãy nêu công thức hoá học của hai hợp chất sodium và hai hợp chất potassium có nhiều ứng dụng trong thực tế mà em biết.
Lời giải:
Hai hợp chất có nhiều ứng dụng trong thực tế của sodium: NaCl (muối ăn), NaHCO3 (baking soda).
Hai hợp chất có nhiều ứng dụng trong thực tế của potassium: KNO3 (thuốc súng), K2SO4 (phân bón).
Câu hỏi 2 trang 115 Hóa học 12: Khối lượng riêng của dầu hoả khan khoảng 0,80 g/cm3. Có thể quan sát được hiện tượng gì khi cho một mẩu lithium vào dầu hoả khan? Vì sao?
Lời giải:
Hiện tượng: Mẩu lithium nổi trên bề mặt dầu hỏa khan.
Vì khối lượng riêng của lithium là 0,53 g/cm3 nhỏ hơn khối lượng riêng của dầu hỏa khan là 0,80 g/cm3.
Câu hỏi 3 trang 115 Hóa học 12: Dự đoán potassium hay lithium phản ứng với nước mạnh hơn.
Lời giải:
Trong nhóm IA, tính khử của kim loại kiềm tăng từ lithium đến caesium nên tính khử của Li < K.
Do đó, ta có thể dự đoán potassium phản ứng với nước mạnh hơn lithium.
Thí nghiệm 1 trang 115 Hóa học 12: Tác dụng với nước
Dùng panh lấy mẩu kim loại (Li, Na hoặc K) cho vào chậu thuỷ tinh chứa khoảng thể tích nước. Thêm vài giọt dung dịch phenolphthalein vào chậu sau khi kim loại tan hết.
Yêu cầu: Nêu các hiện tượng và so sánh mức độ phản ứng.
Lời giải:
Hiện tượng:
- Li chạy từ từ trên mặt nước, có khí bay lên mãnh liệt. Dung dịch chuyển màu hồng khi thêm vài giọt dung dịch phenolphthalein.
- Na chạy nhanh trên mặt nước thành hình vòng tròn, có khí bay lên mãnh liệt. Dung dịch chuyển màu hồng khi thêm vài giọt dung dịch phenolphthalein.
- K chạy nhanh trên mặt nước, có phát nổ và bốc cháy nhẹ, có khí bay lên mãnh liệt. Dung dịch chuyển màu hồng khi thêm vài giọt dung dịch phenolphthalein.
Như vậy, mức độ phản ứng với nước của Li < Na < K.
Thí nghiệm 2 trang 115 Hóa học 12: Tác dụng với oxygen
Dùng panh lấy mẩu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí oxygen. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác.
Yêu cầu: Quan sát hiện tượng thí nghiệm.
Lời giải:
Hiện tượng: Các mẩu kim loại nóng chảy khi hơ trên lửa đèn cồn và bốc cháy mãnh liệt trong bình khí oxygen, xuất hiện khói trắng.
- Li khi cháy cho ngọn lửa đỏ tía.
- Na khi cháy cho ngọn lửa màu vàng.
- K khi cháy cho ngọn lửa màu tím.
Thí nghiệm 3 trang 116 Hóa học 12: Tác dụng với chlorine
Dùng panh lấy mẫu kim loại (Li, Na hoặc K) cho vào muỗng đốt hoá chất (muỗng được xuyên qua một nút cao su). Đốt kim loại trong muỗng trên ngọn lửa đèn cồn và đưa nhanh vào bình tam giác chịu nhiệt chứa khí chlorine. Đậy nhanh nút cao su gắn với muỗng vào miệng bình tam giác.
Yêu cầu: Quan sát hiện tượng thí nghiệm.
Lời giải:
Hiện tượng: Các mẩu kim loại nóng chảy khi hơ trên lửa đèn cồn và bốc cháy mãnh liệt trong bình khí clorine, xuất hiện khói trắng, màu vàng của bình khí chlorine nhạt dần.
- Li khi cháy cho ngọn lửa đỏ tía.
- Na khi cháy cho ngọn lửa màu vàng.
- K khi cháy cho ngọn lửa màu tím.
Luyện tập 1 trang 116 Hóa học 12: Viết phương trình hoá học của phản ứng giữa Na lần lượt với H2O, Cl2 và O2.
Lời giải:
2Na(s) + 2H2O(l) ⟶ 2NaOH(aq) + H2(g)
2Na(s) + Cl2(g) ⟶ 2NaCl(s)
4Na(s) + O2(g) ⟶ 2Na2O(s)
Vận dụng 1 trang 118 Hóa học 12: Ống dẫn nước của bồn rửa bát thường có lớp dầu, mỡ bám vào. Tìm hiểu để giải thích vì sao nên dùng soda, không nên dùng baking soda để tẩy rửa lớp bám này.
Lời giải:
Vì chất béo trong dầu mỡ bị thủy phân trong môi trường kiềm. Mà dung dịch soda (Na2CO3) có tính kiềm cao hơn baking soda (NaHCO3) do đó khả năng tẩy rửa dầu mỡ của soda tốt hơn và tiết kiệm hơn. Do đó nên dùng soda, không nên dùng baking soda để tẩy rửa lớp bám này.
Câu hỏi 4 trang 118 Hóa học 12: Nêu một số lợi ích của việc tái tạo và tái sử dụng ammonia trong phương pháp Solvay.
Lời giải:
Một số lợi ích của việc tái tạo và tái sử dụng ammonia trong phương pháp Solvay:
- Làm giảm lượng ammonia (NH3) cần dùng.
- Giảm chi phí sản xuất, giúp hạ giá thành của sản phẩm baking soda và soda.
Thí nghiệm 4 trang 119 Hóa học 12: Phân biệt các cation Li+, Na+, K+
Nhúng đầu que đốt bằng platinum đã được rửa sạch bằng nước vào dung dịch lithium chloride nồng độ khoảng 25% rồi đưa lên ngọn lửa đèn khí.
Thực hiện thao tác tương tự đối với mỗi dung dịch sodium chloride 25% và dung dịch potassium chloride 25%.
Yêu cầu: Nêu hiện tượng quan sát được.
Lời giải:
Hiện tượng: Trong quá trình đốt, ta thấy ngọn lửa đèn khí trong từng trường hợp có màu khác nhau:
- Lithium chloride: cho ngọn lửa màu đỏ tía.
- Sodium chloride: cho ngọn lửa màu vàng.
- Potassium chloride: cho ngọn lửa màu tím.
Luyện tập 2 trang 119 Hóa học 12: Nhúng đầu dây platinum vào dung dịch hydroxide của một kim loại kiềm; sau đó, đưa đầu dây platinum vào ngọn lửa đèn khí thì có hiện tượng như hình dưới đây. Hãy cho biết dây platinum đã được nhúng vào dung dịch nào sau đây LiOH, NaOH, KOH.
Lời giải:
Ta thấy ngọn lửa có màu đỏ tía.
Vậy dây platinum đã được nhúng vào dung dịch LiOH.
Bài tập
Bài 1 trang 120 Hóa học 12: Các kim loại kiềm khác nhau về những đặc điểm nào sau đây?
(1) Cấu hình electron của nguyên tử.
(2) Số electron hoá trị của nguyên tử.
(3) Số oxi hoá trong các hợp chất.
(4) Mức độ thể hiện tính khử.
Lời giải:
Các kim loại kiềm khác nhau về những đặc điểm:
(1) Cấu hình electron của nguyên tử. Cụ thể: số lớp electron.
(4) Mức độ thể hiện tính khử. Cụ thể: tính khử tăng dần từ Li đến Cs.
Bài 2 trang 120 Hóa học 12: Vì sao trong tự nhiên không tìm thấy đơn chất kim loại kiềm?
Lời giải:
Vì các kim loại kiềm có tính khử rất mạnh, có khả năng tác dụng với nhiều đơn chất, hợp chất trong môi trường ngay ở điều kiện thường để trở thành hợp chất.
Do đó, trong tự nhiên không tìm thấy đơn chất kim loại kiềm.
Bài 3 trang 120 Hóa học 12: Có ba ống nghiệm chứa riêng biệt: dung dịch soda, dung dịch lithium chloride, dung dịch potassium carbonate.
Với mỗi dung dịch, nhúng đầu dây platinum vào rồi đem đốt trên ngọn lửa đèn khí. Dự đoán hiện tượng xảy ra khi đốt mỗi dung dịch.
Lời giải:
Khi đốt mỗi dung dịch ta thấy:
- Dung dịch soda (Na2CO3): ngọn lửa màu vàng.
- Dung dịch lithium chloride (LiCl): ngọn lửa màu đỏ tía.
- Dung dịch potassium carbonate (K2CO3): ngọn lửa màu tím.
Xem thêm các chương trình khác:
- Soạn văn 12 Cánh diều (hay nhất)
- Văn mẫu 12 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 12 – Cánh diều
- Tác giả tác phẩm Ngữ văn 12 - Cánh diều
- Bố cục tác phẩm Ngữ văn 12 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 12 – Cánh diều
- Giải sgk Toán 12 – Cánh diều
- Giải Chuyên đề học tập Toán 12 – Cánh diều
- Lý thuyết Toán 12 – Cánh diều
- Giải sbt Toán 12 – Cánh diều
- Giải sgk Tiếng Anh 12 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 12 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 12 – iLearn Smart World
- Giải sgk Vật lí 12 – Cánh diều
- Giải Chuyên đề học tập Vật lí 12 – Cánh diều
- Lý thuyết Vật lí 12 – Cánh diều
- Giải sbt Vật lí 12 – Cánh diều
- Giải sgk Sinh học 12 – Cánh diều
- Giải Chuyên đề học tập Sinh học 12 – Cánh diều
- Lý thuyết Sinh học 12 – Cánh diều
- Giải sbt Sinh học 12 – Cánh diều
- Giải sgk Lịch sử 12 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 12 – Cánh diều
- Giải sbt Lịch sử 12 – Cánh diều
- Giải sgk Địa lí 12 – Cánh diều
- Giải Chuyên đề học tập Địa lí 12 – Cánh diều
- Giải sbt Địa lí 12 – Cánh diều
- Giải sgk Tin học 12 – Cánh diều
- Giải Chuyên đề học tập Tin học 12 – Cánh diều
- Giải sbt Tin học 12 – Cánh diều
- Lý thuyết Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 – Cánh diều
- Giải sgk Kinh tế pháp luật 12 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Cánh diều
- Giải sbt Kinh tế pháp luật 12 – Cánh diều
- Giải sgk Giáo dục quốc phòng 12 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 – Cánh diều