Giải Hóa 11 Bài 2 (Chân trời sáng tạo): Cân bằng trong dung dịch nước
Với giải bài tập Hóa 11 Bài 2: Cân bằng trong dung dịch nước sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 2.
Giải Hóa 11 Bài 2: Cân bằng trong dung dịch nước
Lời giải:
- Acid là chất cho proton (H+), base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
- Để xác định nồng độ của dung dịch acid, base có thể dùng phương pháp chuẩn độ acid – base.
1. Sự điện li, chất điện li, chất không điện li
Lời giải:
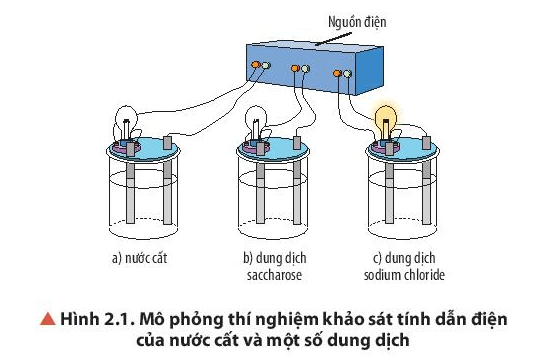
Hiện tượng: Bóng đèn ở cốc đựng dung dịch sodium chloride sáng, còn bóng đèn ở cốc đựng nước cất và dung dịch saccharose không sáng.
⇒ Dung dịch sodium chloride dẫn điện; nước cất và dung dịch saccharose không dẫn điện.
Lời giải:
Dung dịch NaCl có tính dẫn điện do trong nước NaCl có thể phân li ra thành các ion.
NaCl → Na+ + Cl-.
Lời giải:
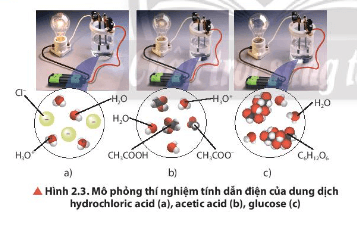
- Độ sáng của bóng đèn ở các thí nghiệm giảm dần theo thứ tự: (a) > (b) > (c).
- Nhận xét:
+ Dung dịch hydrochloric acid (HCl) dẫn điện mạnh.
+ Dung dịch acetic acid (CH3COOH) dẫn điện yếu.
+ Dung dịch glucose (C6H12O6) không dẫn điện.
Lời giải:
- Phương trình (1): HCl → H+ + Cl-
⇒ HCl phân li hoàn toàn trong nước.
- Phương trình (2): CH3COOH ⇌ CH3COO- + H+
⇒ CH3COOH phân li một phần trong nước.
Lời giải:
Cân bằng (2): CH3COOH ⇌ CH3COO- + H+
+ Khi thêm vài giọt dung dịch NaOH, tức thêm OH- sẽ làm giảm H+ do đó cân bằng sẽ chuyển dịch theo chiều làm tăng H+ tức chiều thuận.
+ Khi thêm vài giọt CH3COONa, tức thêm CH3COO- thì cân bằng sẽ chuyển dịch theo chiều làm giảm CH3COO- tức chiều nghịch.
Lời giải:
HNO3 → H+ + NO3-
Ca(OH)2 → Ca2+ + 2OH-
BaCl2 → Ba2+ + 2Cl-
2. Thuyết Br?nsted - Lowry về Acid - Base
Lời giải:
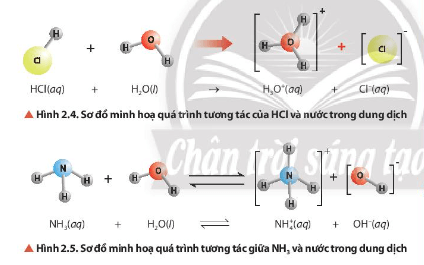
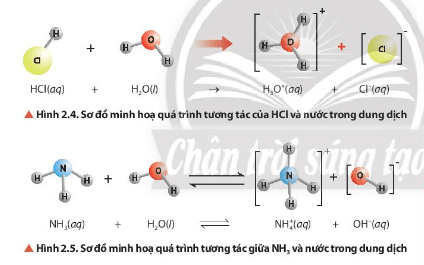
Quan sát hình ảnh xác định được: NH3 nhận H+; HCl cho H+.
Lời giải:
- Trong cân bằng ở Hình 2.4, nước nhận H+ nên đóng vai trò là base.
- Trong cân bằng ở Hình 2.5, nước cho H+ nên đóng vai trò là acid.
- Cân bằng của ion HCO3- trong nước:
HCO-3+H2O⇌H3O++CO2-3(*)
HCO-3+H2O⇌H2CO3+OH-(**)
Trong cân bằng của ion HCO3- trong nước, H2O vừa nhận proton (*) vừa cho proton (**) nên là chất lưỡng tính.
Luyện tập trang 14 Hóa học 11: Cho phương trình:
(1) CH3COOH + H2O ⇌ H3O+ + CH3COO-
Cho biết chất nào là acid, chất nào là base theo thuyết Br?nsted – Lowry.
Lời giải:
- CH3COOH cho proton (H+) nên là acid.
- CO32- nhận proton (H+) nên là base.
3. Khái niệm pH. Chất chỉ thị Acid - Base
Câu hỏi thảo luận 8 trang 15 Hóa học 11: Tính pH của dung dịch có nồng độ H+ là 10-2 M.
Lời giải:
pH = -log[H+] = -log[10-2] = 2.
Câu hỏi thảo luận 9 trang 15 Hóa học 11: Tính pH của dung dịch có nồng độ OH- là 10-4 M.
Lời giải:
Ta có: Kw = [H+].[OH-]
⇒[H+]=10-1410-4=10-10
⇒ pH = -log[H+] = -log[10-10] = 10.
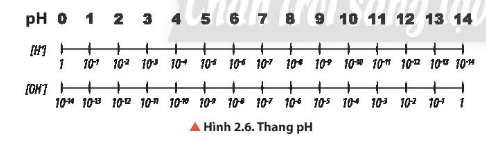
Lời giải:
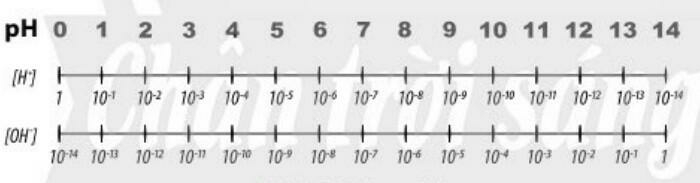
- Môi trường trung tính: [H+] = [OH-] = 10-7 M hay pH = 7.
- Môi trường acid: [H+] > [OH-] hay [H+] > 10-7 M hay pH < 7.
- Môi trường base: [H+] < [OH-] hay [H+] < 10-7 M hay pH > 7.
Luyện tập trang 15 Hóa học 11:
a) Pha 500 mL dung dịch HCl 0,2 M vào 500 mL nước. Tính pH của dung dịch thu được.
b) Tính khối lượng NaOH cần để pha 100 mL dung dịch NaOH có pH = 12.
Lời giải:
a) HCl → H+ + Cl-
nH+ = nHCl = 0,5.0,2 = 0,1 mol.
[H+] = 0,10,5+0,5=0,1(M)
pH của dung dịch thu được: pH = -log[H+] = -log[0,1] = 1.
b) NaOH → Na+ + OH-
pH = 12 Þ [H+] = 10-12 M Þ [OH-] = 10-2 M.
nOH- = 10-2.0,1 = 10-3 (mol).
Khối lượng NaOH cần dùng là: mNaOH = 10-3.40 = 0,04 gam.
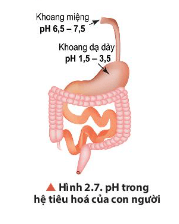
Lời giải:
- Trong khoang miệng, khoảng pH thấp nhất là 6,5; khoảng pH cao nhất là 7,5.
- Trong khoang dạ dày, khoảng pH thấp nhất là 1,5; khoảng pH cao nhất là 3,5.
Lời giải:
- Đất chua là đất dư acid, để cải thiện đất trồng bị chua người ta bón CaO do:
CaO + H2O → Ca(OH)2
Ca(OH)2 là base, sẽ trung hoà bớt acid trong đất chua, làm tăng pH của đất.
- Không bón P2O5 do: P2O5 + 3H2O → 2H3PO4.
H3PO4 là acid, càng làm tăng độ chua của đất.
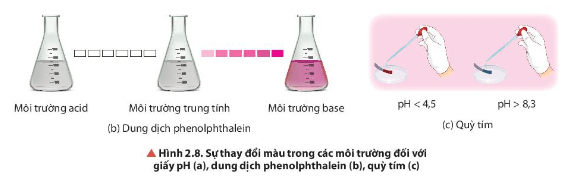
Lời giải:
- Đối với giấy pH:
+ Dung dịch có pH < 7: giấy pH có màu vàng, cam, đỏ (màu đậm nhạt khác nhau tuỳ theo pH, màu càng đậm pH càng thấp).
+ Dung dịch có pH > 7: giấy pH có màu xanh (màu đậm nhạt khác nhau tuỳ theo pH, màu càng đậm khi pH càng cao).
- Đối với phenolphthalein:
+ Môi trường acid, môi trường trung tính không làm đổi màu phenolphthalein.
+ Môi trường base làm phenolphthalein chuyển sang màu hồng.
- Đối với quỳ tím:
+ Dung dịch có pH < 4,5: quỳ tím chuyển sang màu đỏ.
+ Dung dịch có pH > 8,3: quỳ tím chuyển sang màu xanh.
4. Chuẩn độ Acid - Base
Lời giải:
Vai trò của chất chỉ thị trong phương pháp chuẩn độ acid – base là để nhận biết điểm tương đương.
Lời giải:
Cần lắc nhẹ dung dịch trong bình tam giác trong khi thực hiện thao tác chuẩn độ để phản ứng xảy ra tại mọi điểm trong dung dịch.
Lời giải:
Phương trình hoá học:
NaOH + HCl → NaCl + H2O
Hay OH- + H+ → H2O.
Lời giải:
Tại thời điểm kết thúc chuẩn độ dung dịch trong bình tam giác xuất hiện màu hồng nhạt bền trong khoảng 30 giây.
Lời giải:
Nồng độ của dung dịch NaOH ban đầu:
Áp dụng: CHCl.VHCl = CNaOH. VNaOH
⇒CNaOH=CHCl.VHClVNaOH=0,1.1012,5=0,08M
5. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và CO32-
Lời giải:
Ion Al3+, Fe3+ (hay gọi chung là M3+) dễ thuỷ phân trong nước tạo thành hydroxide không tan và cho môi trường acid:
M3+ + 3H2O ⇌ M(OH)3↓ + 3H+ (*)
Trong phòng thí nghiệm người ta thường nhỏ vài giọt dung dịch acid vào trong lọ đựng dung dịch muối M3+ để bảo quản, nhằm cho cân bằng (*) chuyển dịch theo chiều nghịch, hạn chế sự thuỷ phân của muối.
Lời giải:
Phèn chua hay phèn nhôm – kali có công thức: K2SO4.Al2(SO4)3.24H2O.
Khi hoà tan phèn chua trong nước phân li ra ion Al3+:
K2SO4.Al2(SO4)3.24H2O → 2K+ + 2Al3+ + 4SO42- + 24H2O.
Ion Al3+ dễ bị thuỷ phân trong nước tạo thành Al(OH)3 không tan ở dạng keo kéo theo các chất bẩn lơ lửng trong nước lắng xuống và cho môi trường acid:
Al3+ + 3H2O ⇌ Al(OH)3↓ + 3H+
⇒ H+ sinh ra phản ứng với với gỉ sét trên inox, làm sạch inox.
Lời giải:
Phương trình thuỷ phân CO32- được biểu diễn đơn giản như sau:
CO2-3+H2O⇌HCO-3+OH-
Quá trình thuỷ phân này sinh ra OH- làm tăng pH của nước.
Lời giải:
Vôi bột: CaO.
Vôi bột tác dụng với nước: CaO + H2O → Ca(OH)2.
Ca(OH)2 là base, sẽ trung hoà bớt acid trong nước ao, hồ, làm tăng pH của nước ao, hồ.
Bài tập (trang 19)
Lời giải:
[H+]=Kw[OH-]=10-142,5x10-10=4x10-5M
pH = -log[H+] = 4,4.
Dung dịch có môi trường acid do pH < 7.
Lời giải:
Ta có: nHCl = 0,04.0,5 = 0,02 mol; nNaOH = 0,06.0,5 = 0,03 mol.
Phương trình hoá học:
NaOH + HCl → NaCl + H2O
0,03 0,02 mol
Theo phương trình hoá học có NaOH dư 0,01 mol;
NaOH → Na+ + OH-
[OH-] = 0,010,1=0,1M⇒[H+]=10-13M⇒pH=13
Lời giải:
[H+] = 10-pH = 10-2,5 = 3,16.10-3M.
Bài 4 trang 19 Hóa học 11: Viết phương trình điện li của các chất: H2SO4, Ba(OH)2, Al2(SO4)3.
Lời giải:
Phương trình điện li
H2SO4 → H+ + HSO4-
HSO4- ⇌ H+ + SO42-
Ba(OH)2 → Ba2+ + 2OH-
Al2(SO4)3 → 2Al3+ + 3SO42-
Lời giải:
Phèn chua hay phèn nhôm – kali có công thức: K2SO4.Al2(SO4)3.24H2O.
Khi hoà tan phèn chua trong nước phân li ra ion Al3+:
K2SO4.Al2(SO4)3.24H2O → 2K+ + 2Al3+ + 4SO42- + 24H2O.
Ion Al3+ dễ bị thuỷ phân trong nước tạo thành Al(OH)3 không tan ở dạng keo kéo theo các chất bẩn lơ lửng trong nước lắng xuống do đó có tác dụng làm trong nước.
Phương trình phản ứng thuỷ phân: Al3+ + 3H2O ⇌ Al(OH)3↓ + 3H+.
Trong phản ứng thuỷ phân Al3+ đóng vai trò là acid.
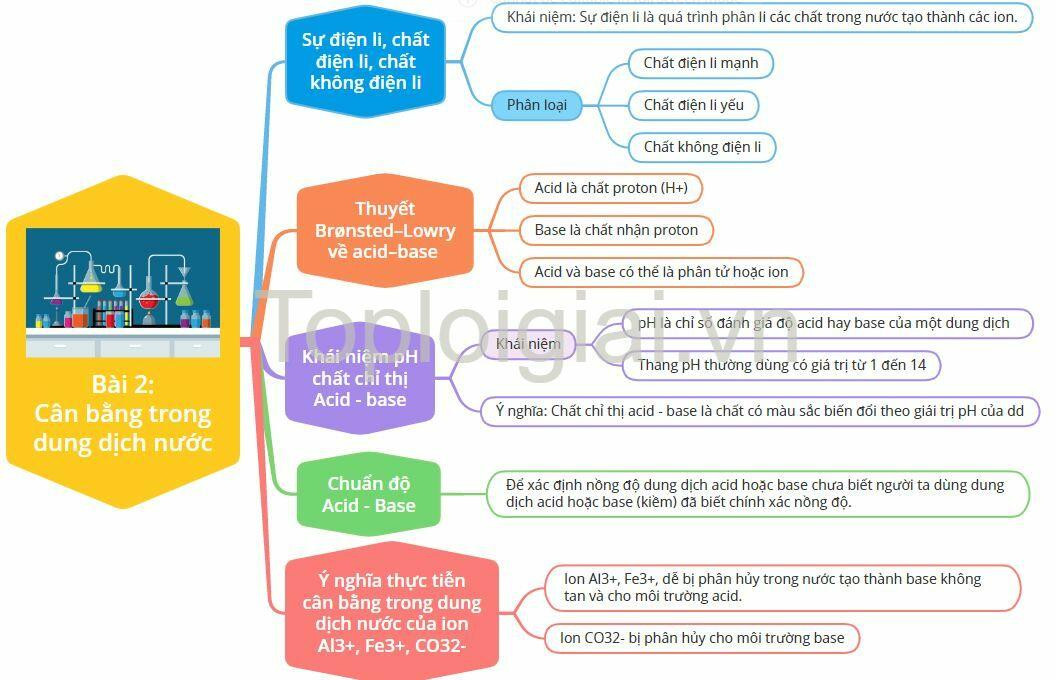
Lý thuyết Cân bằng trong dung dịch nước
1. Sự điện li, chất điện li, chất không điện li
a. Tìm hiểu hiện tượng điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành các ion.
Ví dụ:
NaCl → Na+ + Cl-
NaOH → Na+ + OH-
HCl → H+ + Cl-
b. Tìm hiểu sự phân loại các chất điện li
- Chất điện li mạnh: Là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion
Ví dụ: Axit HCl, HNO3, Bazo mạnh (NaOH, KOH),…
- Chất điện li yếu: Là chất khi tan trong nước, chỉ có một số phân tự hòa tan thành ion, còn lại vẫn tồn tạo ở dạng phân tử
Ví dụ: Axit hữu cơ CH3COOH, axit HClO, H2S, HE,…
- Chất không điện li: Là chất khi hòa tan trong nước, các phân tử không phân li thành ion.
2. Thuyết Brønsted–Lowry về acid–base
- Acid là chất proton (H+)
- Base là chất nhận proton
=> Acid và base có thể là phân tử hoặc ion
CH3COOH + H2O ⇌ CH3COO– + H3O+
3. Khái niệm pH chất chỉ thị Acid - base
a. Tìm hiểu khái niệm pH
- pH là chỉ số đánh giá độ acid hay base của một dung dịch
- Thang pH thường dùng có giá trị từ 1 đến 14
b. Tìm hiểu ý nghĩa của pH trong thực tiễn
- Chất chỉ thị acid - base là chất có màu sắc biến đổi theo giái trị pH của dung dịch

4. Chuẩn độ Acid - Base
- Để xác định nồng độ dung dịch acid hoặc base chưa biết người ta dùng dung dịch acid hoặc base (kiềm) đã biết chính xác nồng độ.
5. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+, CO32-
a. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+
- Ion Al3+, Fe3+, dễ bị phân hủy trong nước tạo thành base không tan và cho môi trường acid.
b. Tìm hiểu ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion CO32-
CO32- +H2O ⇌ HCO3- + HO-
- Ion CO32- bị phân hủy cho môi trường base
Sơ đồ tư duy Cân bằng trong dung dịch nước
Xem thêm lời giải bài tập Hóa học lớp 11 Chân trời sáng tạo với cuộc sống hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 11 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 11 - Chân trời sáng tạo
- Giải SBT Ngữ văn 11 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 11 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Chân trời sáng tạo
- Soạn văn 11 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Toán 11 – Chân trời sáng tạo
- Lý thuyết Toán 11 - Chân trời sáng tạo
- Giải sbt Toán 11 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 11 – Friends Global
- Giải sbt Tiếng Anh 11 - Friends Global
- Trọn bộ Từ vựng Tiếng Anh 11 Friends Global đầy đủ nhất
- Bài tập Tiếng Anh 11 Friends Global theo Unit có đáp án
- Giải sgk Vật lí 11 – Chân trời sáng tạo
- Lý thuyết Vật lí 11 – Chân trời sáng tạo
- Giải sbt Vật lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Vật lí 11 – Chân trời sáng tạo
- Giải sgk Sinh học 11 – Chân trời sáng tạo
- Lý thuyết Sinh học 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Sinh học 11 – Chân trời sáng tạo
- Giải sbt Sinh học 11 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Chân trời sáng tạo
- Lý thuyết Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sbt Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sgk Lịch sử 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Lịch sử 11 – Chân trời sáng tạo
- Lý thuyết Lịch sử 11 - Chân trời sáng tạo
- Giải sbt Lịch sử 11 – Chân trời sáng tạo
- Giải sgk Địa lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Địa lí 11 – Chân trời sáng tạo
- Lý thuyết Địa lí 11 - Chân trời sáng tạo
- Giải sbt Địa lí 11 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 11 – Chân trời sáng tạo