Giải bài tập trang 66 Chuyên đề Hóa 10 Bài 10 - Cánh diều
Với giải bài tập trang 66 Chuyên đề Hóa 10 trong Bài 10: Tính tham số cấu trúc và năng lượng phân của phân tử sách Chuyên đề Hóa lớp 10 Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời các câu hỏi & làm bài tập Chuyên đề Hóa 10 trang 66.
Giải bài tập trang 66 Chuyên đề Hóa 10 - Cánh diều
Bài tập 1 trang 66 Chuyên đề Hóa 10: Sử dụng phương pháp PM7 để xác định đồng phân cis-2-butene hay trans-2-butene bền hơn. Biết rằng, đồng phân có năng lượng tổng âm hơn sẽ bền hơn:
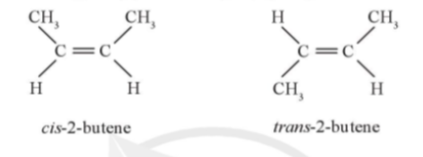
Trả lời:
- Đồng phân cis-2-butene có năng lượng tổng là -599,1911 EV
(Phần kết quả: ![]() )
)
- Đồng phân trans-2-butene có năng lượng tổng là -599,2290 EV
(Phần kết quả: ![]() )
)
⇒ trans-2-butene bền hơn do có năng lượng tổng âm hơn.
Bài tập 2 trang 66 Chuyên đề Hóa 10: Sử dụng phương pháp PM7 tính cấu trúc (độ dài liên kết, góc liên kết), nhiệt tạo thành, năng lượng tổng của 3 đồng phân o, m, p-cresol. So sánh độ bền giữa các đồng phân.
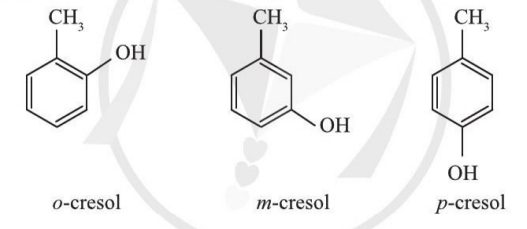
Trả lời:
Sử dụng phương pháp PM7 ta có bảng sau:
|
Đồng phân |
o-cresol |
m-cresol |
p-cresol |
|
|
Nhiệt tạo thành (kJ/mol) |
-129,08980 |
-134,94981 |
-130,75217 |
|
|
Năng lượng tổng (EV) |
-1263,1321 |
-1263,1939 |
-1263,1509 |
|
|
Độ dài liên kết () |
d(C-O) |
1,36 |
1,359 |
1,36 |
|
d(O-H) |
0,987 |
0,987 |
0,987 |
|
|
d(C-CH3) |
1,489 |
1,491 |
1,491 |
|
|
Góc liên kết (o) |
|
112,336o |
112,251o |
112,141o |
Đồng phân có năng lượng tổng âm hơn sẽ bền hơn. Dựa vào kết quả ta thấy độ bền của các đồng phân được sắp xếp như sau: o-cresol < p-cresol < m-cresol.
Bài tập 3 trang 66 Chuyên đề Hóa 10: Cho dãy hợp chất H2X, với X là các nguyên tố nhóm VIA gồm O, S, Se. Sử dụng phương pháp tính PM7 để tối ưu hóa cấu trúc, từ đó tính độ dài liên kết X-H và góc HXH. Tìm quy luật biến đổi các giá trị này trong dãy nêu trên.
Trả lời:
Với hợp chất H2O:
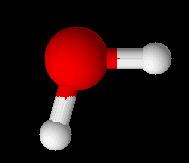
d(O-H) = 0,956
Góc = 105,399o
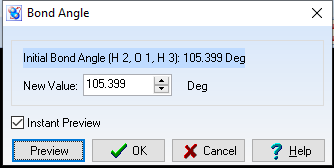
Với hợp chất H2S:
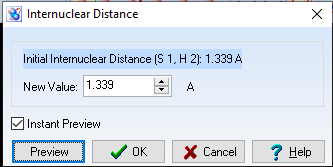
d(S-H) = 1,339
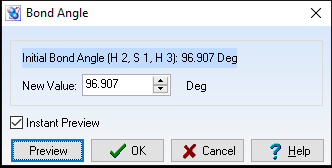
Góc = 96,907o
Với hợp chất H2Se:
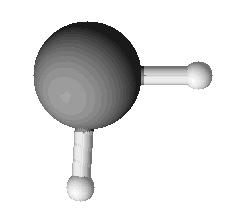
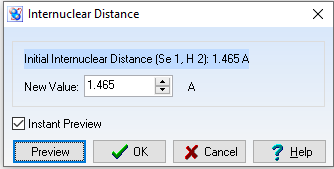
d(Se-H) = 1,465
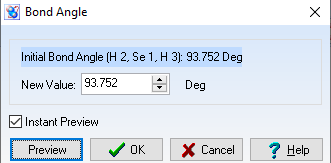
Góc = 93,752 o
Nhận xét:
Trong nhóm VIA từ O đến Se độ dài liên kết X-H tăng dần; góc liên kết HXH giảm dần.
Bài tập 4 trang 66 Chuyên đề Hóa 10: Sử dụng phương pháp PM7 để tối ưu hóa cấu trúc, từ đó tính (độ dài liên kết, góc liên kết) các chất có trong các phương trình phản ứng sau:
O2(g) + 2H2(g) → 2H2O(g) (1)
F2(g) + H2(g) → 2HF (g) (2)
a) Tính biến thiên enthalpy của phản ứng (1) và (2) theo phương pháp PM7. So sánh kết quả nhận được với kết quả tính từ enthalpy tạo thành chuẩn của các chất trong Phụ lục 2.
b*) Tính biến thiên năng lượng của phản ứng (1) và (2). Từ đó, so sánh khả năng phản ứng của oxygen và fluorine với hydrogen.
Biết rằng, biến thiên năng lượng của phản ứng cũng được tính giống như biến thiên enthalpy của phản ứng, nhưng thay nhiệt tạo thành bởi năng lượng tổng của phân tử.
Chú ý: Enthalpy tạo thành chuẩn của các đơn chất ở trạng thái bền bằng 0.
Trả lời:
a) Tính biến thiên enthalpy của phản ứng (1) và (2) theo phương pháp PM7:
∆f(H2O) = -241,83333 kJ.mol-1
∆f(HF) = -259,13839 kJ.mol-1
∆r(1) = 2. ∆f(H2O) – 1.0 – 2.0 = 2.(-241,83333) = -483,66666 kJ
∆r(2) = 2. ∆f(HF) – 1.0 – 1.0 = 2.(-259,13839) = -518,27678 kJ
Tính biến thiên enthalpy của phản ứng (1) và (2) theo enthalpy tạo thành ở phụ lục 2:
∆f(H2O) = -241,8 kJ.mol-1
∆f(HF) = -273,3 kJ.mol-1
∆r(1) = 2. ∆f(H2O) – 1.0 – 2.0 = 2.(-241,8) = -483,6 kJ
∆r(2) = 2. ∆f(HF) – 1.0 – 1.0 = 2.(-273,3) = -546,6 kJ
So sánh: Kết quả nhận được với kết quả tính từ enthalpy tạo thành chuẩn của các chất trong Phụ lục 2 là xấp xỉ nhau.
b*) Biến thiên năng lượng của phản ứng (1)
= 2.năng lượng tổng H2O – (năng lượng tổng O2 + 2.năng lượng tổng H2)
= 2. (-322,6792) – [-585,9147 + 2.( -28,0470)]
= -3,3497 eV
Biến thiên năng lượng của phản ứng (2)
= 2.năng lượng tổng HF – (năng lượng tổng F2 + năng lượng tổng H2)
= 2.(-479,5304) – [-927,7183 + (-28,0470)]
= -3,2955 eV
Nhận xét:
Phản ứng giữa hydrogen và fluorine xảy ra thuận lợi hơn.
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều với cuộc sống hay, chi tiết khác:
Giải bài tập trang 65 Chuyên đề Hóa 10 Bài 10
Giải bài tập trang 67 Chuyên đề Hóa 10 Bài 10
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều hay, chi tiết khác:
Luyện tập trang 65 Chuyên đề Hóa 10: Tính lại cấu trúc của C6H5OH trong dung môi nước...
Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 5: Sơ lược về phản ứng cháy và nổ
Bài 6: Hóa học về phản ứng cháy và nổ
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều
