Có những sơ đồ phản ứng hóa học sau Cl2 + H2O
Với giải bài 4 trang 108 sgk Hóa học lớp 10 được biên soạn lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập môn Hóa 10. Mời các bạn đón xem:
Giải Hóa 10 Bài 24: Sơ lược về hợp chất có oxi của clo
Video Giải Bài 4 trang 108 Hóa lớp 10
Bài 4 trang 108 Hóa lớp 10: Có những sơ đồ phản ứng hóa học sau:
a) Cl2 + H2O → HCl + HClO
b) CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
c) Cl2 + KOH → KCl + KClO3 + H2O
d) HCl + KClO3 → KCl + Cl2 + H2O
e) NaClO + CO2 + H2O → NaHCO3 + HClO
f) CaOCl2 → CaCl2 + O2
Cho biết những phản ứng nào là phản ứng oxi hóa – khử và vai trò các chất tham gia phản ứng oxi hóa – khử. Hoàn thành phương trình hóa học của các phản ứng.
Lời giải:
Phản ứng oxi hóa – khử là phản ứng có sự thay đổi số oxi hóa của một hay một vài nguyên tố.
a) Quá trình nhường, nhận electron:
1x1x|0Cl→+1Cl+1e0Cl+1e→−1Cl
→ Cl2 vừa là chất oxi hóa, vừa là chất khử.
Phương trình: Cl2 + H2O → HCl + HClO
b)
Công thức cấu tạo của CaOCl2 là:
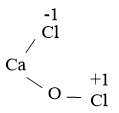
Quá trình nhường, nhận electron:
1x1x|−1Cl→0Cl+1e+1Cl+1e→0Cl
→ CaOCl2 là phân tử tự oxi hóa – khử, HCl đóng vai trò môi trường.
→ Phương trình:
CaOCl2 + 2HCl → CaCl2 + Cl2↑ + H2O
c) Quá trình nhường, nhận electron:
1x5x|0Cl→+5Cl+5e0Cl+1e→Cl−
→ Cl2 vừa là chất oxi hóa vừa là chất khử.
→ Phương trình:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
d) Quá trình nhường, nhận electron:
3x1x|−12Cl→0Cl2+2e+5Cl+6e→−1Cl
→ HCl là chất khử, KClO3 là chất oxi hóa.
→ Phương trình:
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
e) Phương trình:
NaClO + CO2 + H2O → NaHCO3 + HClO
→ Không phải phản ứng oxi hóa khử.
f) Công thức cấu tạo của CaOCl2 là:
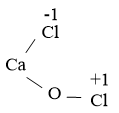
Quá trình nhường, nhận electron:
1x2x|2−2O→0O2+4e+1Cl+2e→−1Cl
→ CaOCl2 là phân tử tự oxi hóa – khử.
→ Phương trình:
2CaOCl2 → 2CaCl2 + O2↑
Xem thêm lời giải bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 2 trang 108 Hóa 10: Nêu tính chất hóa học chính và ứng dụng của nước Gia-ven, clorua vôi...
Bài 5 trang 108 Hóa 10: Trong phòng thí nghiệm có canxi oxit, nước, MnO2, axit H2SO4...
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
