Sách bài tập Hóa học 10 Bài 15 (Kết nối tri thức): Phản ứng oxi hóa – khử
Với giải sách bài tập Hóa học 10 Bài 15. Phản ứng oxi hóa – khử sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 15.
Giải sách bài tập Hóa học 10 Bài 15. Phản ứng oxi hóa – khử
Nhận biết
Lời giải
Đáp án đúng là: B
Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
Bài 15.2 trang 39 SBT Hóa học 10: Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là
Lời giải
Đáp án đúng là: D
Số oxi hóa của O thường là -2
Đặt x là số oxi hóa của S
⇒ x.1 + (-2).3 = 0 ⇒ x = +6
Vậy số oxi hóa của S là +6
Lời giải
Đáp án đúng là: A
Số oxi hóa được viết ở dạng đại số, dấu viết trước, số viết sau ⇒ B sai.
Đặt x là số oxi hóa của Fe. O thường có số oxi hóa là -2
⇒ Ta có: x.2 + (-2).3 = 0
⇒ x = +3
Lời giải
Đáp án đúng là: D
Đặt x là số oxi hóa của N. H thường có số oxi hóa là +1
⇒ Ta có: x.1 + (+1).3 = 0
⇒ x = -3
Bài 15.5 trang 39 SBT Hóa học 10: Chromium có số oxi hóa +2 trong hợp chất nào sau đây?
Lời giải
Đáp án đúng là: C
+3Cr(OH)3, Na2+6CrO4, +2CrCl2, +3Cr2O3
Bài 15.6 trang 39 SBT Hóa học 10: Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận
Lời giải
Đáp án đúng là: A
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận electron.
Lời giải
Đáp án đúng là: B
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi số oxi hóa của các nguyên tử.
Bài 15.8 trang 39 SBT Hóa học 10: Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
Lời giải
Đáp án đúng là: B
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất nhận electron, chất khử là chất nhường electron.
Trong phản ứng trên, chất đóng vai trò chất khử là
Lời giải
Đáp án đúng là: C
Chất khử là chất nhường electron (số oxi hóa tăng).
Chất oxi hóa là chất nhận electron (số oxi hóa giảm).
⇒ H2 là chất khử, CuO là chất oxi hóa.
Bài 15.10 trang 40 SBT Hóa học 10: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
D. Ca(OH)2 + CO2 → CaCO3 + H2O
Lời giải
Đáp án đúng là: A
Phản ứng:
Là phản ứng oxi hóa khử vì có xảy ra quá trình nhường, nhận electron (có sự thay đổi số oxi hóa của các chất trong phản ứng).
Thông hiểu
Bài 15.11 trang 40 SBT Hóa học 10: Cho các chất sau: Cl2, HCl, NaCl, KClO3, HClO4
Số oxi hóa của nguyên tử Cl trong phân tử các chất trên lần lượt là
Lời giải
Đáp án đúng là: B
Lời giải
Đáp án đúng là: C
Đặt số oxi hóa của manganse trong ion permanganate là x
Số oxi hóa của O thường là -2. Ta có:
x.1 + (-2).4 = -1 ⇒ x = +7
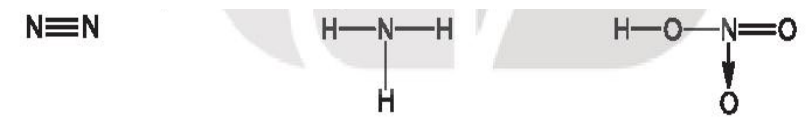
Bài 15.13 trang 40 SBT Hóa học 10: Cho các phân tử có công thức cấu tạo sau:
Số oxi hóa của nguyên tử N trong các phân tử trên lần lượt là
Lời giải
Đáp án đúng là: D
Bài 15.14 trang 40 SBT Hóa học 10: Carbon đóng vai trò chất oxi hóa ở phản ứng nào sau đây?
Lời giải
Đáp án đúng là: D
Số oxi hóa của C giảm từ 0 xuống -4 trong phản ứng
C + 2H2 CH4
⇒ C là chất oxi hóa.
Bài 15.15 trang 40 SBT Hóa học 10: Thực hiện các phản ứng hóa học sau:
Số phản ứng sulfur đóng vai trò chất oxi hóa là
Lời giải
Đáp án đúng là: B
Sulfur đóng vai trò chất oxi hóa trong phản ứng (b) và (c) vì có số oxi hóa giảm từ 0 xuống -2.
Lời giải
Đáp án đúng là: C
Các phản ứng đốt cháy nhiên liệu oxygen dạng O2 tạo thành H2O và CO2.
Số oxi hóa giảm từ 0 xuống -2 ⇒ Oxygen đóng vai trò là chất oxi hóa.
D. 2NaOH + Cl2 → NaCl + NaClO + H2O
Lời giải
Đáp án đúng là: D
Số oxi hóa của chlorine vừa tăng, vừa giảm sau phản ứng:
Bài 15.18 trang 41 SBT Hóa học 10: Cho các phản ứng hóa học sau:
(d) 2NaHCO3 Na2CO3 + CO2 + H2O
Số phản ứng có kèm theo sự thay đổi số oxi hóa của các nguyên tử là
Lời giải
Đáp án đúng là: C
Chỉ có phản ứng (b) có kèm theo sự thay đổi số oxi hóa của các nguyên tử.
Xét phản ứng đốt cháy methane trong buồng động cơ xe buýt sử dụng nhiên liệu CNG:
a) Xác định các nguyên tử có sự thay đổi số oxi hóa. Viết quá trình oxi hóa, quá trình khử.
b) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron.
Lời giải
a)
Chất khử: CH4
Chất oxi hóa: O2
Quá trình oxi hóa:
Quá trình khử:
b)
Xác định được hệ số của CH4 và CO2 đều là 1, hệ số của O2 là 2, sau đó cân bằng nguyên tố H tìm được hệ số của H2O là 2
CH4 + 2O2 CO2 + 2H2O
Bài 15.20 trang 41 SBT Hóa học 10: Xét phản ứng sản xuất Cl2 trong công nghiệp:
a) Xác định các nguyên tử có sự thay đổi số oxi hóa. Chỉ rõ chất oxi hóa, chất khử.
b) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron.
Lời giải
a)
NaCl là chất khử, H2O là chất oxi hóa.
Quá trình oxi hóa:
Quá trình khử:
b)
Xác định được hệ số của NaCl và NaOH đều là 2, hệ số của Cl2 và H2 đều là 1, sau đó cân bằng nguyên tố H tìm được hệ số của H2O là 2:
2NaCl + 2H2O 2NaOH + Cl2 + H2
Vận dụng
a) Xác định các nguyên tử có sự thay đổi số oxi hóa. Viết các quá trình oxi hóa, quá trình khử.
b) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron.
Lời giải
a)
Quá trình oxi hóa:
Quá trình khử:
b) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron:
Xác định được hệ số của ZnS, ZnO và SO2 đều là 2, hệ số của O2 là 3:
2ZnS + 3O2 2ZnO + 2SO2
a) Xác định các nguyên tố có sự thay đổi số oxi hóa. Chỉ rõ chất oxi hóa, chất khử.
b) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron.
Lời giải
C4H10 là chất khử, O2 là chất oxi hóa
Quá trình oxi hóa:
Quá trình khử:
b)
Xác định được hệ số của C4H10 là 2, hệ số của CO2 là 8, hệ số của O2 là 13, hệ số của H2O là 10:
2C4H10 + 13O2 8CO2 + 10H2O
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
b) Tính thể tích dung dịch KMnO4 0,02M để phản ứng vừa đủ với 20 mL dung dịch FeSO4 0,10M.
Lời giải
a)
FeSO4 là chất khử, KMnO4 là chất oxi hóa
Quá trình oxi hóa:
Quá trình khử:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Lời giải
Lưu ý: 1 mol khí ở điều kiện chuẩn có thể tích là 24,79 L
Sơ đồ phản ứng:
Phương trình phản ứng: 2M + 2nH2SO4 → M2(SO4)n + nSO2 + 2nH2O
Theo phương trình phản ứng ta có:
⇒
Với n = 1 ⇒ MM = 9 loại
Với n = 2 ⇒ MM = 18 loại
Với n = 3 ⇒ MM = 27 (Al)
Vậy kim loại M là Al (Aluminium)
Xem thêm lời giải sách bài tập Hóa học 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 15. Phản ứng oxi hóa – khử
Bài 17. Biến thiên enthalpy trong phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức