Sách bài tập Hóa 10 Bài 4 (Kết nối tri thức): Ôn tập chương 1
Với giải sách bài tập Hóa 10 Bài 4: Ôn tập chương 1 sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa 10 Bài 4.
Giải sách bài tập Hóa lớp 10 Bài 4: Ôn tập chương 1
Nhận biết
Bài 4.1 trang 10 SBT Hóa học 10: Số proton, neutron và electron của C5224r3+ lần lượt là
Lời giải:
Đáp án đúng là: B
Số hiệu nguyên tử Z = số proton = 24 = số electron (của Cr nguyên tử).
Số neutron = Số khối – số proton = 52 – 24 = 28.
Cr nhường 3 electron tạo thành Cr3+ ⇒ Số electron (của Cr3+) = 24 – 3 = 21
Bài 4.2 trang 10 SBT Hóa học 10: Tổng số hạt neutron, proton, electron trong ion C3517l− là
Lời giải:
Số hiệu nguyên tử Z = số proton = 17 = số electron (của Cl nguyên tử)
Số neutron = Số khối – số proton = 35 – 17 = 18.
Cl nhận 1 electron tạo thành Cl- ⇒ Số electron (của ion Cl-) = 17 + 1 = 18
Lời giải:
Đáp án đúng là: A
Cấu hình electron của M (Z = 20) là: 1s22s22p63s23p64s2
Nguyên tử M nhường 2 electron lớp ngoài cùng để tạo thành ion M2+
⇒Cấu hình electron của ion M2+ là1s22s22p63s23p6
Lời giải:
Đáp án đúng là: C
Nguyên tử X nhận 2 electron để tạo thành anion X2-
⇒Cấu hình electron của X là 1s22s22p4
Lời giải:
Đáp án đúng là: C
- Nguyên tử O (Z = 8) có cấu hình electron là: 1s22s22p4
Nguyên tử O nhận 2 electron để tạo thành ion O2-
⇒ Cấu hình electron của ion O2- là: 1s22s22p6
- Nguyên tử F (Z = 9) có cấu hình electron là: 1s22s22p5
Nguyên tử F nhận 1 electron để tạo thành ion F-
⇒ Cấu hình electron của ion F- là: 1s22s22p6
- Nguyên tử Cl (Z = 17) có cấu hình electron là: 1s22s22p63s23p5
Nguyên tử Cl nhận 1 electron để tạo thành ion Cl-
⇒ Cấu hình electron của ion Cl- là: 1s22s22p63s23p6
- Nguyên tử Mg (Z = 12) có cấu hình electron là: 1s22s22p63s2
Nguyên tử Mg nhường đi 2 electron lớp ngoài cùng để tạo thành ion Mg2+
⇒ Cấu hình electron của ion Mg2+ là: 1s22s22p6
- Cấu hình electron của Ne (Z = 10) là: 1s22s22p6
Vậy ion O2- không có cùng số electron với ion Cl-
Lời giải:
Đáp án đúng là: A
Cấu hình electrond đầy đủ của X2-là 1s22s22p63s23p6
⇒Tổng số electron ở lớp vỏ của X2- là 18.
Thông hiểu
Lời giải:
Đáp án đúng là: B
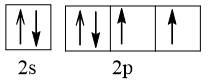
Cấu hình electron lớp ngoài cùng biểu diễn trên AO là:
⇒ Có 2 electron độc thân.
Lời giải:
Đáp án đúng là: C
Số hiệu nguyên tử = số electron = 14
⇒ Cấu hình electron là: 1s22s22p63s23p2
⇒ Electron cuối cùng điền vào lớp M (n = 3), phân lớp p
Cấu hình electron của nguyên tử Y là
Lời giải:
Đáp án đúng là: B
Các electron được điền vào các lớp và phân lớp theo mức năng lượng như sau:
1s22s22p63s23p64s23d6
Sắp xếp lại: 1s22s22p63s23p63d64s2
Lời giải:
Đáp án đúng là: C
Electron được điền vào các lớp và phân lớp theo mức năng lượng như sau:
1s22s22p63s23p64s23d2
Sắp xếp lại: 1s22s22p63s23p63d24s2
⇒Tổng số electron của nguyên tử nguyên tố X là 22
Bài 4.11 trang 11 SBT Hóa học 10: Ion nào sau đây không có cấu hình electron của khí hiếm?
Lời giải:
Đáp án đúng là: D
|
Cấu hình electron nguyên tử |
Cấu hình electron ion tương ứng |
|
Na (Z = 11): 1s22s22p63s1 |
Na+: 1s22s22p6 |
|
Al (Z = 13): 1s22s22p63s23p1 |
Al3+: 1s22s22p6 |
|
Cl (Z = 17): 1s22s22p63s23p5 |
Cl-: 1s22s22p63s23p6 |
|
Fe (Z = 26): 1s22s22p63s23p63d64s2 |
Fe2+: 1s22s22p63s23p63d6 |
Vậy ion Fe2+ không có cấu hình giống khí hiếm (8 electron lớp ngoài cùng)
Vận dụng
Lời giải:
Đáp án đúng là: A
Cấu hình electron của X là: 1s22s22p63s23p1
⇒ Số electron của X = số proton = 13
Cấu hình electron của Y là: 1s22s22p63s23p3
⇒ Số electron của Y = số proton = 15
Lời giải:
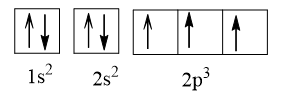
Z = 7:
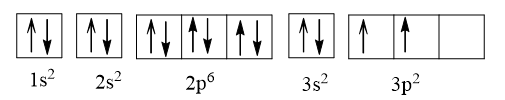
Z = 14:
Giải thích: Cấu hình electron được viết tuân theo nguyên lí vững bền, nguyên lí Pauli và phần 2p3, 3p2 tuân theo quy tắc Hund.
+) Z = 21 (1s22s22p63s23p63d14s2): nguyên tử có 3 electron hóa trị, dễ nhường electron, là kim loại.
Giải thích: Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng của các electron trong mỗi phân lớp tăng dần từ trái sang phải.
Các nguyên tố trên là kim loại, hay phi kim hay khí hiếm?
Lời giải:
Cấu hình electron nguyên tử của các nguyên tố
Z = 9 (1s22s22p5) ⇒ lớp ngoài cùng có 7e ⇒ phi kim.
Z = 16 ([Ne]3s22p4) ⇒ lớp ngoài cùng có 6e ⇒ phi kim.
Z = 18 (1s22s22p63s23p6) ⇒ lớp ngoài cùng có 8e ⇒ khí hiếm.
Z = 20 ([Ar]4s2) ⇒ lớp ngoài cùng có 2e ⇒ kim loại.
Z = 29 ([Ar]3d104s1) ⇒ lớp ngoài cùng có 1e ⇒ kim loại.
Lời giải:
Đáp án đúng là: D
Với các nguyên tử bền ta có: 1 ≤ NZ ≤ 1,52 (1)
Theo bài ra có:
2Z + N = 13 ⇒ N = 13 – 2Z, thay vào (1) ta có:
1≤13−2ZZ≤1,52
⇔ Z ≤ 13 – 2Z ≤ 1,52Z
⇔ 3,69 ≤ Z ≤ 4,33
Chọn Z = 4 ⇒ N = 5
⇒Cấu hình electron của nguyên tử X là1s22s2
Lời giải:
Đáp án đúng là: A
Tổng số hạt cơ bản là 46 nên ta có: p + e + n = 46 hay 2p + n = 46 (1)
Hạt mang điện là p và e; hạt không mang điện là n nên ta có:
p + e – n = 14 hay 2p – n = 14 (2)
Từ (1) và (2) ⇒ p = e = 15, n = 16
Cấu hình electron nguyên tử của R là: [Ne]3s22p3
Lời giải:
Tổng các hạt cơ bản của X: p + e + n = 155 hay 2p + n = 155 (1)
Hạt mang điện là p + e và hạt không mang điện là n nên ta có:
2p – n = 33 (2)
Giải hệ (1) và (2) ta được: p = 47; n = 61
⇒ Nguyên tố X có Z = số p = 47.
Số khối bằng p + n = 47 + 61 = 108
⇒ X là silver ( A10847g)
a) Viết kí hiệu nguyên tử của nguyên tố X.
b) Xác định số lượng các hạt cơ bản trong ion X2+ và viết cấu hình electron của ion đó.
Lời giải:
a) Tổng các hạt cơ bản của X: p + e + n = 82 hay 2p + n = 82 (1)
Hạt mang điện là p + e và hạt không mang điện là n nên ta có:
2p – n = 22 (2)
Giải hệ (1) và (2) ta được: p = 26; n = 30
⇒ Nguyên tố X có Z = số p = 26.
Số khối bằng p + n = 26 + 30 = 56
⇒ X là iron (F5626e )
b) Nguyên tử Fe nhường 2 electron để tạo thành ion Fe2+
Cấu hình electron của Fe: 1s22s22p63s23p63d64s2.
Cấu hình electron của ion Fe2+ là: 1s22s22p63s23p63d6
a) Viết cấu hình electron nguyên tử của A và B.
Lời giải:
a) Cấu hình electron của A và B có dạng:
[Ne]3s23p63dx4sy (0 ≤ x ≤ 10; 1 ≤ y ≤ 2)
- Nếu y = 1 thì cấu hình của A2+ là: [Ne]3s23p63dx-1
Khi đó có: 2 + 6 + x – 1 = 17 ⇒ x = 10
Cấu hình electron của A là: [Ar]3d104s1
⇒ A là 29Cu
- Nếu y = 2 thì cấu hình của A2+ là: [Ne]3s23p63dx
Khi đó có: 2 + 6 + x = 17 ⇒ x = 9
Cấu hình electron của A là: [Ar]3d94s2 (không bền vững)
Xét tương tự với B:
- Nếu y = 1 thì cấu hình electron của B là [Ar]3d74s1 (không hợp lí)
- Nếu y = 2 thì cấu hình electron của B là [Ar]3d64s1 . B là 26Fe
b) Tổng số proton trong X là 87.
⇒ pA + pB + 2pY = 87
⇔ 29 + 26 + 2.pY = 87
⇔ pY = 16
⇒ Y là 16S
Vậy quặng X có công thức là: CuFeS2
Bài giảng Hóa học 10 Bài 4: Ôn tập chương 1 - Kết nối tri thức
Xem thêm lời giải sách bài tập Hóa học 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Bài 7. Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức