Sách bài tập Hóa học 10 Bài 12 (Kết nối tri thức): Liên kết cộng hóa trị
Với giải sách bài tập Hóa học 10 Bài 12. Liên kết cộng hóa trị sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 12.
Giải sách bài tập Hóa học 10 Bài 12. Liên kết cộng hóa trị
Nhận biết
C. một cặp electron góp chung.
D. một hay nhiều cặp electron dùng chung
Lời giải:
Đáp án đúng là: C
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung
Ví dụ: Liên kết cộng hóa trị trong phân tử HCl

Bài 12.2 trang 32 SBT Hóa học 10: Hợp chất nào sau đây có liên kết cộng hóa trị không phân cực?
Lời giải:
Đáp án đúng là: D
Hiệu độ âm điện trong phân tử N2 bằng 0.
Bài 12.3 trang 32 SBT Hóa học 10: Hợp chất nào sau đây có liên kết cộng hóa trị phân cực?
Lời giải:
Đáp án đúng là: B
- H2 và N2 có hiệu độ âm điện bằng 0 ⇒ Có liên kết cộng hóa trị không phân cực.
- Hợp chất CHCl3 gồm 1 liên kết C-H và 3 liên kết C-Cl
Hợp chất CH4 gồm 4 liên kết C-H
(C-H) = |2,55 – 2,2| = 0,35 ⇒ Liên kết cộng hóa trị không phân cực
(C-Cl) = |2,55 – 3,16| = 0,61 ⇒ Liên kết cộng hóa trị phân cực.
Vậy hợp chất CHCl3 có liên kết cộng hóa trị không phân cực.
Bài 12.4 trang 32 SBT Hóa học 10: Liên kết σ là liên kết hình thành do
A. sự xen phủ bên của hai orbital
C. lực hút tĩnh điện giữa hai ion
D. sự xen phủ trục của hai orbital.
Lời giải:
Đáp án đúng là: D
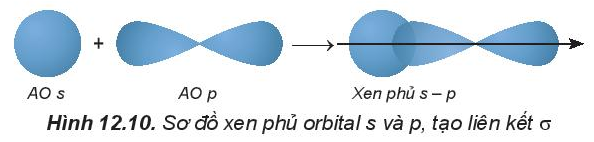
Liên kết σ là liên kết hình thành do sự xen phủ trục của hai orbital.
Ví dụ:
Bài 12.5 trang 32 SBT Hóa học 10: Liên kết π là liên kết hình thành do
A. sự xen phủ bên của hai orbital
C. lực hút tĩnh điện giữa hai ion
D. sự xen phủ trục của hai orbital
Lời giải:
Đáp án đúng là: A
Liên kết π là liên kết hình thành do sự xen phủ bên của hai orbital
Lời giải:
Đáp án đúng là: B
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử HCl được hình thành bởi sự xen phủ orbital s – p.
Lời giải:
Đáp án đúng là: A
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử HCl được hình thành bởi sự xen phủ orbital s – p.
Lời giải:
Đáp án đúng là: C
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
O (Z = 8): 1s22s22p4
A. Liên kết trong phân tử H2 được hình thành nhờ sự xem phủ orbital s – s.
B. Liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
C. Liên kết trong phân tử NH3 được hình thành bởi sự xen phủ orbital s – p.
D. Liên kết trong phân tử O2 được hình thành bởi sự xen phủ orbital p – p.
Thông hiểu
Bài 12.9 trang 32 SBT Hóa học 10: Các liên kết trong phân tử oxygen gồm
Lời giải:
Đáp án đúng là: C
Trong phân tử oxygen (O2) hai nguyên tử O liên kết với nhau bằng 1 liên kết đôi (O=O).
1 liên kết đôi gồm 1 liên kết σ, 1 liên kết π
Bài 12.10 trang 32 SBT Hóa học 10: Số liên kết σ và π có trong phân tử C2H2 lần lượt là
Lời giải:
Đáp án đúng là: D
Công thức cấu tạo của C2H2 là: H-C≡C-H
Liên kết 3 gồm 1 liên kết σ và 2 liên kết π.
⇒ Tổng số liên kết σ và π có trong phân tử C2H2 lần lượt là: 3 và 2
Bài 12.11 trang 33 SBT Hóa học 10: Dãy nào sau đây gồm các chất chỉ có liên kết cộng hóa trị?
Lời giải:
Đáp án đúng là: C
A. BaCl2 và NaCl chứa liên kết ion.
B. Na2O2 chứa liên kết ion
D. CaCl2 chứa liên kết ion.
B. X2Y3: liên kết cộng hóa trị
Lời giải:
Đáp án đúng là: D
X (Z = 20): 1s22s22p63s23p64s2
Y (Z = 17): 1s22s22p63s23p5
Nguyên tử X là kim loại mạnh, có xu hướng nhường đi 2 electron lớp ngoài cùng tạo thành cation X2+.
Nguyên tử Y là phi kim điển hình, có xu hướng nhận thêm 1 electron và lớp ngoài cùng tạo thành anion Y-.
Ion X2+ và Y- trái dấu hút nhau tạo thành phân tử XY2. Liên kết được tạo thành là liên kết ion.
X2+ + 2Y- → XY2
Lời giải:
Tuy có độ âm điện của chlorine và nitrogen gần bằng nhau nhưng do trong phân tử Cl2 có liên kết đơn σ (Cl-Cl) còn trong phân tử N2 có liên kết ba (N≡N) gồm 1 liên kết σ và 2 liên kết π rất bền vững. Năng lượng cần để phá vỡ liên kết ba trong phân tử N2 lớn hơn nhiều so với năng lượng cần để phá vỡ một liên kết đơn trong phân tử Cl2. Do đó, ở điều kiện thường, N2 hoạt động kém Cl2.
Vận dụng
Bài 12.14 trang 33 SBT Hóa học 10: Cho các phân tử sau: F2, N2, H2O, CO2.
a) Hãy viết công thức Lewis của các phân tử đó.
Lời giải:
a) Công thức Lewis của các phân tử:
F2
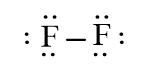
N2
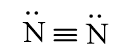
H2O
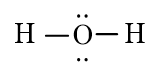
CO2
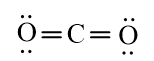
b) Phân tử chứa liên kết cộng hóa trị không phân cực: N2, F2.
Phân tử chứa liên kết cộng hóa trị phân cực: H2O, CO2.
Phân tử phân cực: H2O.
Phân tử không phân cực: N2, F2, CO2.
Bài 12.15 trang 33 SBT Hóa học 10: Cho các phân tử sau: Br2, H2S, CH4, NH3, C2H4, C2H2
b) Phân tử nào chỉ có liên kết đơn? Phân tử nào có liên kết đôi? Phân tử nào có liên kết ba?
Lời giải:
a) Phân tử có liên kết cộng hóa trị không phân cực: Br2.
Phân tử có liên kết cộng hóa trị phân cực: H2S, CH4, NH3, C2H4 và C2H2.
b) Phân tử chỉ có liên kết đơn: H2S, CH4, NH3 và Br2.
Phân tử có liên kết đôi: CH2=CH2.
Phân tử có liên kết ba: CH≡CH.
Bài 12.16 trang 33 SBT Hóa học 10: Ghép nhiệt độ nóng chảy với chất tương ứng và giải thích
Lời giải:
a) - 3);
b) – 4);
c) – 2);
d) – 1).
Nước, băng phiến, butane là các hợp chất cộng hóa trị, phân tử có độ phân cực không cao nên dễ tách ra khỏi nhau khi đun nóng. Ngược lại, NaCl là tinh thể ion có lực hút mạnh giữa các ion nên khó tách ra khỏi nhau và có nhiệt độ nóng chảy cao.
Xem thêm lời giải sách bài tập Hóa học 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
