Nhôm(III) oxit tác dụng với axit sunfuric theo phương trình phản ứng
Với giải bài 5 trang 132 sgk Hóa học lớp 8 được biên soạn lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập môn Hóa 8. Mời các bạn đón xem:
Giải Hóa 8 Bài 38: Bài luyện tập 7
Video Giải Bài 5 trang 132 Hóa học lớp 8
Bài 5 trang 132 Hóa học lớp 8: Nhôm(III) oxit tác dụng với axit sunfuric theo phương trình phản ứng sau :
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tính lượng muối nhôm sunfat được tạo thành nếu đã sử dụng 49 gam axit sunfuric nguyên chất tác dụng với 60 gam nhôm oxit. Sau phản ứng chất nào còn dư ? Lượng dư của chất đó là bao nhiêu ?
Lời giải:
= 49 : 98 = 0,5 mol
= 60 : 102 = 0,59 mol
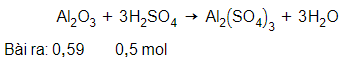
So sánh tỉ lệ → Vậy Al2O3 dư, H2SO4 hết. Số mol sản phẩm thu được tính theo số mol H2SO4.
Theo phương trình hóa học ta có:
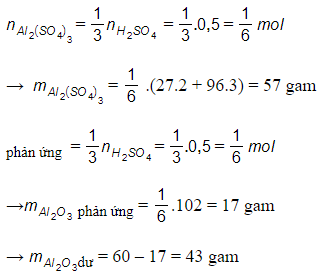
Xem thêm lời giải sách bài tập Hóa học lớp 8 hay, chi tiết khác:
Bài 1 trang 131 Hóa 8: Tương tự như natri...
Bài 2 trang 132 Hóa 8: Hãy lập phương trình hóa học của những phản ứng có sơ đồ sau đây...
Bài 3 trang 132 Hóa 8: Viết công thức hóa học của những muối có tên gọi dưới đây...
Bài 4 trang 132 Hóa 8: Cho biết khối lượng mol của một oxit kim loại là 160 gam...
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 8 (hay nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Soạn văn 8 (ngắn nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Văn mẫu lớp 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Vật Lí 8
- Giải sbt Vật Lí 8
- Lý thuyết Vật Lí 8
- Giải vở bài tập Vật lí 8
- Giải SGK Toán 8 | Giải bài tập Toán 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Toán 8 (sách mới) | Sách bài tập Toán 8
- Bài tập Ôn luyện Toán lớp 8
- Các dạng bài tập Toán lớp 8
- Lý thuyết Toán lớp 8 (sách mới) | Kiến thức trọng tâm Toán 8
- Giáo án Toán lớp 8 mới nhất
- Bài tập Toán lớp 8 mới nhất
- Chuyên đề Toán lớp 8 mới nhất
- Giải sgk Tiếng Anh 8 (sách mới) | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2
- Giải sgk Tiếng Anh 8 | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 8 (sách mới) | Sách bài tập Tiếng Anh 8
- Giải sbt Tiếng Anh 8 (thí điểm)
- Giải sgk Tin học 8 | Giải bài tập Tin học 8 Học kì 1, Học kì 2 (sách mới)
- Giải sgk Lịch Sử 8 | Giải bài tập Lịch sử 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch sử 8 (sách mới) | Kiến thức trọng tâm Lịch sử 8
- Giải vở bài tập Lịch sử 8
- Giải Tập bản đồ Lịch sử 8
- Đề thi Lịch Sử 8
- Giải vở bài tập Sinh học 8
- Giải sgk Sinh học 8
- Lý thuyết Sinh học 8
- Giải sgk Giáo dục công dân 8 | Giải bài tập Giáo dục công dân 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Giáo dục công dân 8 (sách mới) | Kiến thức trọng tâm GDCD 8
- Lý thuyết Địa Lí 8 (sách mới) | Kiến thức trọng tâm Địa Lí 8
- Giải sgk Địa Lí 8 | Giải bài tập Địa Lí 8 Học kì 1, Học kì 2 (sách mới)
- Giải Tập bản đồ Địa Lí 8
- Đề thi Địa lí 8
