Trắc nghiệm Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (có đáp án)
Trắc nghiệm Bài 28: Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng
-
298 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Natri hiđrocacbonat (thuốc muối) được dùng để giảm đau dạ dày do thừa axit
Natri hiđrocacbonat có khả năng trung hòa axit trong dạ dày
NaHCO3 + HCl → NaCl + H2O + CO2
Câu 2:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
+ Xuất hiện kết tủa trắng:
CO2 + Ca(OH)2 → CaCO3 trắng + H2O
+ CO2 dư kết tủa tan dần:
CO2 + CaCO3 + H2O → Ca(HCO3)2
Câu 3:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
- Các tính chất vật lí (nhiệt độ sôi, nhiệt độ nóng chảy, khối lượng riêng) của các kim loại trong nhóm IA biến đổi có quy luật vì các kim loại đều có cấu tạo mạng tinh thể lập phương tâm khối.
- Kim loại kiềm thổ (kim loại nhóm IIA) không có cùng cấu tạo mạng tinh thể nên tính chất vật lí biến đổi không có tính quy luật.
+ Be, Mg: mạng tinh thể lục phương
+ Ca, Cr: mạng tinh thể lập phương tâm diện.
+ Ba: mạng tinh thể lập phương tâm khối
Câu 4:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Gọi nguyên tử khối trung bình của hai kim loại là A, tổng số mol là n, hoá trị trung bình là x (1 < x < 2).
Ta có: An = 7,1 (1)
Bảo toàn electron: nKL. Hóa trị = 2.
→ xn = 0,5 (2)
Từ (1) và (2) → = 14,2
Vì 1< x < 2
→ 14,2 < A < 28,4
Chỉ có cặp Na và Mg thoả mãn
Câu 5:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phản ứng tạo khí H2. Khối lượng dung dịch tăng:
mdd tăng = mKL -
→ 7 = 7,8 - 2.
→ = 0,4 mol
Bảo toàn electron:
3.nAl + 2.nMg = 2.= 0,8 (1)
Lại có mAl + mMg = m hỗn hợp
→ 27.nAl + 24.nMg = 7,8 (2)
→ nAl = 0,2 mol; nMg = 0,1 mol
→ mAl = 0,2.27 = 5,4 gam;
mMg = 0,1.24 = 2,4 gam
Câu 6:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Dùng anion để làm kết tủa hết cation Ca2+ và Mg2+ trong dung dịch
+ Ca2+ → CaCO3
+ Mg2+ → MgCO3
Câu 7:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Kim loại kiềm chỉ được điều chế bằng phương pháp điện phân nóng chảy muối halogenua hoặc hiđroxit của chúng.
Câu 8:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương trình phản ứng
![]()
Câu 9:
23/07/2024Hoà tan 46 gam một hỗn hợp Ba và hai kim loại kiềm A, B thuộc hai chu kì kế tiếp nhau vào nước thu được dung dịch C và 11,2 lít khí (đktc). Nếu thêm 0,18 mol Na2SO4 vào dung dịch C thì dung dịch sau phản ứng vẫn chưa kết tủa hết Ba. Nếu thêm 0,21 mol Na2SO4 vào dung dịch C thì dung dịch sau phản ứng còn dư Na2SO4. A và B là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi nguyên tử khối trung bình của hai kim loại là X (g/mol), tổng số mol là a (mol).
Số mol của Ba là b (mol).
Ta có: Xa + 137b = 46
Khi tác dụng với nước thu được khí. Bảo toàn electron:
2.nBa + nX = 2.
→ 2b + a = 0,5.2 = 1
Vì 0,18 < b < 0,21
Vậy : 0,58 < a < 0,64 và 17,23 < Xa < 21,34
Suy ra 26,92 < X < 36,79
Vậy hai kim loại là Na và K
Câu 10:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Ca(OH)2 có khả năng làm mềm nước cứng tạm thời
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
Câu 11:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Sử dụng dung dịch amoniac
+ Xuất hiện kết tủa trắng, không tan trong NH3 dư → AlCl3
AlCl3 + 3NH3 + 3H2O → Al(OH)3+ 3NH4Cl
+ Xuất hiện kết tủa trắng xanh, để trong không khí kết tủa chuyển dần sang nâu đỏ → FeCl2
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
+ Xuất hiện kết tủa trắng, tan trong NH3 dư → ZnCl2.
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
+ Không có hiện tượng gì → NaCl
Câu 12:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Gọi công thức chung của hai kim loại là R
nR = nRCl = x mol
→ (MR + 35,5)x = a (1)
→ (2MR + 96). = b (2)
Từ (1) và (2) → b – a = 12,5x
→ x =
Câu 13:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Trong dãy hoạt động hóa học của kim loại, đi từ trái sang phải tính khử của kim loại giảm dần
K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
→ Tính khử của kim loại: Al < Mg < Na < K
Câu 14:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
= 0,12 mol
= 0,24 mol
Gọi = x (mol)
→ nHCl = 4x (mol)
→ = 6x mol
→ 6x = 0,24
→ x = 0,04 mol
→ = 0,04 mol;
nHCl = 4.0,04 = 0,16 mol
→ m muối = m kim loại + m gốc axit
= 8,94 + 0,04.96 + 0,16.35,5
= 18,46 gam.
Câu 15:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
A. Sai vì Na2SO4 không tác dụng với Al2O3
B. Sai vì KNO3 không tác dụng với Al2O3
C. Đúng, phương trình phản ứng:
6HNO3 + Al2O3 2Al(NO3)3 + 3H2O
6HCl + Al3O2 2AlCl3 + 3H2O
2NaOH + Al3O2 2NaAlO2 + H2O
D. Sai vì NaCl không tác dụng với Al2O3
Câu 16:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
= 0,01.1 + 2.0,01.0,5 = 0,02 mol
Phản ứng trung hòa luôn có:
= 0,02 mol
→ VNaOH = 0,02 lít
Câu 17:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Gọi số mol Al là x (mol)
→ nNa = 2x (mol)
Bảo toàn electron:
3.nAl + 1.nNa = 2.
→ 3x + 2x = 2.0,2
→ x = 0,08
→ m = 27.nAl + 23.nNa
= 27.0,08 + 23.2.0,08 = 5,84 gam
Câu 18:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Ta có pH = 13
→ pOH = 14 – 13 =1
→ [OH-] = 0,1 M
→ = 0,1.0,5 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng:
Ta có: m(bazơ) = m (kim loại) +
= 2,22 + 0,05 .17 = 3,07 g
Câu 19:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Gọi số mol Na2CO3 x mol , KHCO3 x mol , Ba(HCO3)2 y mol
Nhận thấy dung dịch X tác dụng vừa đủ với 0,16 mol NaOH :
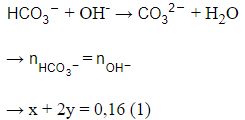
Nếu dung dịch X chỉ có thì lượng HCl cần dùng tối đa là 0,16 mol < 0,24 mol
= y mol
→ Trong dung dịch X còn chứa dư : (x - y) mol
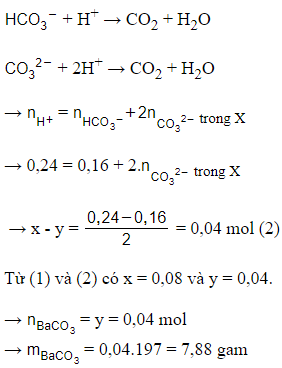
Câu 20:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
= 0,07mol;
nNaOH = 0,08 mol
= 1,14
→ Cả hai chất tham gia phản ứng hết, sản phẩm tạo 2 muối.
= 0,08 – 0,07 = 0,01 mol
= 2.0,07 – 0,08 = 0,06 mol
Thêm dung dịch Y vào X:
+ OH- → + H2O (1)
Ba2+ + → BaCO3↓
= 0,02 mol < = 0,25.0,16 = 0,04 mol
→ = = 0,02 mol
phản ứng (1) = phản ứng (1) = 0,02 – 0,01 = 0,01 mol
→ = 0,005 mol
a = mol/l
Câu 21:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Anion PO43- có thể làm mềm mọi loại nước cứng.
3Ca2+ + 2PO43- Ca3(PO4)2↓
3Mg2+ + 2PO43- Mg3(PO4)2↓.
Câu 22:
23/07/2024Cho các chất sau: Ca(OH)2, KOH, CaCO3, Ca(HCO3)2, KNO3, Mg(OH)2.
Số chất bị nhiệt phân có chất khí trong sản phẩm tạo thành là
 Xem đáp án
Xem đáp án
Đáp án C
Có ba chất khi bị nhiệt phân sinh ra chất khí là: CaCO3; Ca(HCO3)2; KNO3.
CaCO3 CaO + CO2
Ca(HCO3)2 CaCO3 + CO2 + H2O
2KNO3 2KNO2 + O2
Câu 23:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa.
Câu 24:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
2R + 2nHCl → 2RCln + nH2↑
Vậy R là nhôm (Al)
Câu 25:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án B
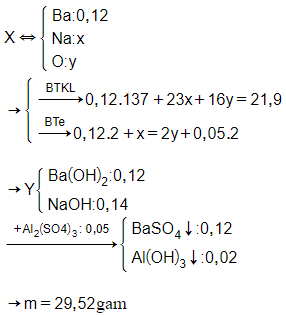
Câu 26:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
D. Sai. Các kim loại kiềm thổ đều phản ứng với ngước ở nhiệt độ thường trừ Be và Mg.
Câu 27:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Kim loại Mg được dùng để chế tạo những hợp kim có tính cứng, nhẹ, bền. Những hợp kim này được dùng để chế tạo máy bay, tên lửa, ôtô,..Kim loại Mg còn được dùng để tổng hợp nhiều chất hữu cơ. Một Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm.
→ Đáp án B sai. Mg không dùng để chế tạo dây dẫn điện.
Câu 28:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Ba(HCO3)2 + H2SO4 → BaSO4 + 2H2O + 2CO2
Câu 29:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án D
+) Ca(HCO3)2 là muối lưỡng tính ( là ion lưỡng tính)
+) NH4+ có tính axit, CO32- có tính bazơ → (NH4)2CO3 là muối lưỡng tính.
+) Al(OH)3, Zn(OH)2 là hiđroxit lưỡng tính.
+ NH4Cl và ZnSO4 là hai muối có môi trường axit
Câu 30:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
n hỗn hợp khí = 0,56 : 22,4 = 0,025 mol
nMg = 3,6 : 24 = 0,15 mol
→ = 0,15 mol
Bảo toàn nguyên tố N:
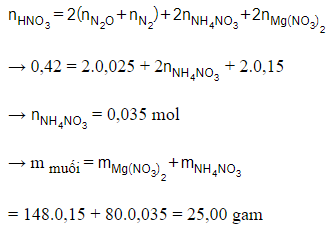
Có thể bạn quan tâm
- Trắc nghiệm Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (có đáp án) (297 lượt thi)
- Trắc nghiệm Hóa 12 Bài 28 (có đáp án): Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng (240 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (Nhận biết) (238 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (Thông hiểu) (331 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (Vận dụng) (232 lượt thi)
Các bài thi hot trong chương
- Trắc nghiệm Kim loại kiềm và hợp chất của kim loại kiềm (có đáp án) (1191 lượt thi)
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm cơ bản (958 lượt thi)
- 100 câu trắc nghiệm Kim loại kiềm, Kiềm thổ, Nhôm nâng cao (909 lượt thi)
- Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm (có đáp án) (583 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm (có đáp án) (511 lượt thi)
- Trắc nghiệm Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ (có đáp án) (489 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án (Nhận biết) (327 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án (Vận dụng) (309 lượt thi)
- Trắc nghiệm Kim loại kiềm thổ có đáp án (Nhận biết) (308 lượt thi)
- Trắc nghiệm Kim loại kiềm và hợp chất quan trọng của kim loại kiềm có đáp án (Nhận biết) (306 lượt thi)
