Trắc nghiệm Nhôm và hợp chất của nhôm (có đáp án)
Trắc nghiệm Bài 27: Nhôm và hợp chất của nhôm
-
512 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình electron của nguyên tử nguyên tố Al (Z = 13): 1s22s22p63s23p1
Câu 2:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phèn chua có công thức hóa học là K2SO4.Al2(SO4)3.24H2O hoặc KAl(SO4)2.12H2O
Câu 3:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
= 0,25 mol
Áp dụng định luật bảo toàn electron:
3.nAl = 2.
→ mAl = .27 = 4,5 gam
Câu 4:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Đặt số mol Al trong m gam Al bằng x (mol)
Bảo toàn electron cho phản ứng của Al với HCl
3.nAl = 2.
→ 3x = 2.
Bảo toàn electron cho phản ứng của Al với Ba(OH)2
→ 3.2x = 2.
→ = 2.
→ = 2.0,1 = 0,2 mol
→ V = 0,2.22,4 = 4,48 lít
Câu 5:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Pirit: FeS2
Thạch cao: CaSO4.nH2O
Mica: K2O.Al2O3.6SiO2.2H2O
Apatit: Ca5F(PO4)3 hay 3Ca3(PO4)2.CaF2
Criolit: Na3AlF6 hay AlF3.3NaF
Boxit: Al2O3.nH2O
Đolomit: CaCO3.MgCO3 (đá bạch vân)
→ Quặng mica, criolit, boxit chứa nhôm
Câu 6:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Cặp chất nào không phản ứng với nhau có thể cùng tồn tại trong một dung dịch
A. 3Na2CO3 + 2AlCl3 + H2O → 2Al(OH)3 + 6NaCl + 3CO2
B. HNO3 + NaHCO3 → NaNO3 + H2O + CO2
C. Cùng tồn tại
D. NaCl + AgNO3 → NaNO3 + AgCl
Câu 7:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hiđroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan, còn với Al(OH)3 không tan trong NH3
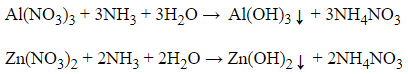
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn), tạo thành các dung dịch phức chất.
Câu 8:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Bảo toàn số mol electron:
→ 3nAl = + 3nNO
→ 3.nAl = 0,12 + 3.0,08
→ nAl = 0,12 mol
→ mAl = 0,12.27 = 3,24g
Câu 9:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
2Al + 3Hg(NO3)2 → 2Al(NO3)3 + 3Hg
Al sẽ tạo với Hg hỗn hống. Hỗn hống Al tác dụng với nước tạo ra khí H2
2Al + 6H2O → 2Al(OH)3 + 3H2
Câu 10:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Ban đầu có kết tủa keo trắng ngay lập tức
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
Khi NaOH dư, kết tủa tan dần
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Câu 11:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Công thức muối Ba(AlO2)2
nAl = 2nBa (1)
Lại có: mAl + mBa = 3,82
→ 27.nAl + 137.nBa = 3,82 (2)
nAl = 0,04 mol; nBa = 0,02 mol
→ mBa = 0,02.137 = 2,740 gam
Câu 12:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Al không phản ứng với HNO3 đặc, nguội, H2SO4 đặc nguội
Câu 13:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phản ứng nhiệt nhôm là phản ứng cho nhôm tác dụng với oxit kim loại ở nhiệt độ cao.
Câu 14:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án A
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
Al2O3 + 2NaOH 2NaAlO2 + H2O.
Câu 15:
17/07/2024Cho phương trình phản ứng:
aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O.
Tỉ lệ a : b là
 Xem đáp án
Xem đáp án
Đáp án D
Al + 4HNO3 Al(NO3)3 + NO + 2H2O
→ a : b = 1 : 4
Câu 16:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án B
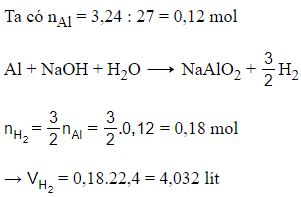
Câu 17:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Nhôm hiđroxit thu được khi thổi dư CO2 vào dung dịch natri aluminat
Phương trình phản ứng:
![]()
Câu 18:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Nhôm là kim loại hoạt động mạnh. Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước, kể cả khi đun nóng.
Câu 19:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án A
A. Đúng, Al2O3 được sinh ra khi nhiệt phân muối Al(NO3)3
4Al(NO3)3 2Al2O3 + 12NO2 + 3O2.
B. Sai, CO chỉ khử được oxit của kim loại đứng sau nhôm trong dãy hoạt động hóa học.
C. Sai, Al2O3 không tan được trong dung dịch NH3
D. Sai, Al2O3 phản ứng với axit tạo muối.
VD: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Câu 20:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Trong hóa vô cơ, hợp chất lưỡng tính có thể là oxit, hiđroxit, muối.
A. Sai, không có khái niệm kim loại lưỡng tính.
B. Sai, Al(OH)3 là một hiđroxit lưỡng tính
C. Sai, Al2O3 là oxit lưỡng tính.
D. Đúng
Câu 21:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Trong công nghiệp, Al được sản xuất từ quặng boxit bằng phương pháp điện phân nóng chảy.
2Al2O3 4Al + 3O2
Câu 22:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
= 0,03
Bảo toàn electron: 3.nAl = 2.
→ nAl = 0,02
→ mAl = 0,54g
Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02
→
→ bđ = 0,03 mol
Bảo toàn nguyên tố Al
→ = nAl + 2. bđ
= 0,08 mol
thu được = 3,57 : 102 = 0,035 mol
= 0,07 mol
Trường hợp 1:
NaAlO2 + HCl + H2O Al(OH)3 + NaCl
nHCl = = 0,07 mol
→ CM HCl = = 0,35M
Trường hợp 2:
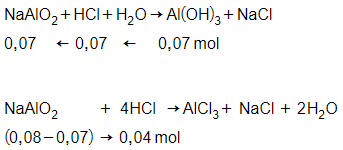
→ nHCl = 0,11 mol
→ CM HCl = = 0,55M
Câu 23:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Sục khí CO2 đến dư vào dung dịch NaAlO2 xuất hiện kết tủa keo trắng không tan.
Phương trình phản ứng
NaAlO2 + CO2 + 2H2O Al(OH)3↓ + NaHCO3.
Câu 24:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Trích mẫu thử của hai dung dịch ra hai ống nghiệm có đánh số.
Nhỏ NaOH dư vào từng ống nghiệm
- Xuất hiện kết tủa trắng sau đó kết tủa tan: AlCl3
AlCl3 + 3NaOH Al(OH)3 + 3NaCl
Al(OH)3 + NaOH NaAlO2 + 2H2O
- Không có hiện tượng gì: KCl
Câu 25:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
= 0,01 mol
→ = 2. = 0,02 mol
mà = = 0,01 mol < 0,02 nên có 2 trường hợp
Trường hợp 1:
= 3. = 0,03 mol
→ CM NaOH = = 1,2M.
Trường hợp 2:
= 4. –
= 4.0,02 – 0,01 = 0,07 mol
→ CM NaOH = = 2,8M
Câu 26:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
2Al + 3Cl2 2AlCl3
Câu 27:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
nAl = 8,1 : 27 = 0,3 mol
Áp dụng định luật bảo toàn khối lượng:
→ m + 8,1 = 0,15.102 + 50,2
→ m = 57,4 gam
Câu 28:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
+ Nhôm (Al) là kim loại màu trắng bạc, mềm, dẻo, nhẹ, dẫn điện dẫn nhiệt tốt.
+ Al được ứng dụng rộng rãi trong đời sống: sản xuất hợp kim siêu nhẹ làm máy bay, tên lửa; trang trí; chế tạo dây dẫn điện; hàn đường ray.
Câu 29:
23/07/2024Cho các phát biểu sau đây:
(1) Theo chiều tăng dần của điện tích hạt nhân, khối lượng riêng của các kim loại kiềm giảm dần.
(2) Hợp kim Na-Al siêu nhẹ, dùng trong kĩ thuật chân không.
(3) Trong quá trình điện phân Al2O3 nóng chảy, cực dương được bố trí là một tấm than chì nguyên chất được bố trí ở đáy thùng.
(4) Dựa vào thành phần hóa học và tính chất cơ học, người ta chia thép thành 2 loại là thép mềm và thép cứng. Thép mềm là thép có chứa không quá 1% C.
(5) Trong quả gấc có chứa nhiều vitamin A.
Số phát biểu sai là:
 Xem đáp án
Xem đáp án
Đáp án D
(1) Sai. Theo chiều tăng dần của điện tích hạt nhân, khối lượng riêng của các kim loại kiềm tăng dần.
(2) Sai. Hợp kim Al-Li là hợp kim của nhôm với Li. Li là một kim loại nguyên tố có tỷ trọng rất thấp, thì nếu bổ sung vào nhôm sẽ cho hợp kim có tỷ trọng thấp hơn nhôm nguyên tố. Nếu bổ sung vào hợp kim một lượng 1% Li thì sẽ làm cho hợp kim Al-Li nhẹ đi 3% và tăng độ cứng lên 5%. Hợp kim Al-Li rất quan trọng và được sử dụng rộng rãi trong công nghiệp vũ trụ, do lợi thế vế trọng lượng riêng. Hiện tại hợp kim này đang được sử dụng cho ngành hàng không và các dự án máy bay lên thẳng.
(3) Sai. Trong quá trinh điện phân Al2O3 nóng chảy, cực dương được bố trí là nhiều tấm than chì có thể chuyển động theo phương thẳng đứng.
(4) Sai. Thép mềm là thép có chứa không quá 0,1% C.
(5) Sai. Trong quả gấc có chứa nhiều tiến tố của vitamin A.
→ Cả 5 phát biểu đều sai
Câu 30:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Vai trò của criolit (3 vai trò)
+ Tạo hỗn hợp điện phân có tỉ khối nhẹ hơn Al.
+ Làm cho nhiệt độ nóng chảy của Al2O3 giảm, tiết kiệm điện năng.
+ Tạo cho hỗn hợp điện phân dẫn điện tốt hơn.
Có thể bạn quan tâm
- Trắc nghiệm Nhôm và hợp chất của nhôm (có đáp án) (511 lượt thi)
- 14 Câu trắc nghiệm nhôm và hợp chất của nhôm có đáp án (290 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án (Nhận biết) (327 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án (Thông hiểu) (255 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án (Vận dụng) (309 lượt thi)
Các bài thi hot trong chương
- Trắc nghiệm Kim loại kiềm và hợp chất của kim loại kiềm (có đáp án) (1191 lượt thi)
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm cơ bản (958 lượt thi)
- 100 câu trắc nghiệm Kim loại kiềm, Kiềm thổ, Nhôm nâng cao (909 lượt thi)
- Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm (có đáp án) (583 lượt thi)
- Trắc nghiệm Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ (có đáp án) (489 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (Thông hiểu) (331 lượt thi)
- Trắc nghiệm Kim loại kiềm thổ có đáp án (Nhận biết) (308 lượt thi)
- Trắc nghiệm Kim loại kiềm và hợp chất quan trọng của kim loại kiềm có đáp án (Nhận biết) (306 lượt thi)
- Trắc nghiệm Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (có đáp án) (298 lượt thi)
- Trắc nghiệm Kim loại kiềm và hợp chất quan trọng của kim loại kiềm có đáp án (Thông hiểu) (262 lượt thi)
