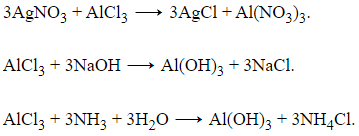Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm (có đáp án)
Trắc nghiệm Bài 29: Luyện tập tính chất của nhôm và hợp chất của nhôm
-
584 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp duy nhất điều chế Al là điện phân nhóng chảy oxit nhôm, trong hỗn hợp có criolit nóng chảy ở 90oC với điện cực là C than chì
Câu 2:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phản ứng nhiệt nhôm là phản ứng Al khử oxit kim loại (kim loại đứng sau Al trong dãy hoạt động hóa học) thành kim loại
2Al + Fe2O3 Al2O3 + 2Fe
Câu 4:
19/07/2024Cho 2 phương trình phản ứng sau:
(1) 2Al + 6HCl → 2AlCl3 + 3H2
(2) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Trong các kết luận sau, kết luận nào không đúng?
 Xem đáp án
Xem đáp án
Đáp án C
Nhôm không phải là chất lưỡng tính, nó tác dụng được với dung dịch kiềm là do tác dụng với nước tạo Al(OH)3 tan trong dung dịch kiềm.
Câu 5:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
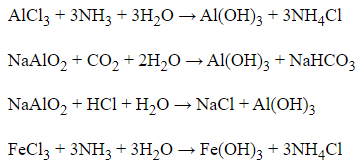
Câu 6:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Để thu được lượng kết tủa lớn nhất thì HCl phản ứng vừa đủ với NaAlO2, không còn dư để hòa tan kết tủa.
Phương trình phản ứng:
NaAlO2 + HCl + H2O → NaCl + Al(OH)3
→ a = b
Câu 7:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Khi cho phèn chua vào nước sẽ phân li ra ion Al3+. Chính ion Al3+ này bị thủy phân theo phương trình:
Al3+ + 3H2O → Al(OH)3↓ + 3H+
Kết quả tạo ra Al(OH)3 là chất kết tủa dạng keo nên khi khuấy phèn chua vào nước, nó kết dính các hạt đất nhỏ lơ lửng trong nước đục thành hạt đất to hơn, nặng và chìm xuống làm trong nước.
Câu 8:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Gọi nồng độ mol của Al2(SO4)3 và KOH lần lượt là a và b (mol/l)
Trường hợp 1: 150 ml dung dịch B vào 200 ml dung dịch A, KOH hết, Al2(SO4)3 dư
→ 0,15b = 6.
→ b = 0,08M
Trường hợp 2: 600ml dung dịch B vào 200 ml dung dịch A, Al2(SO4)3 phản ứng hết tạo kết tủa, kết tủa này tan một phần trong KOH dư
→ 0,6.0,08 = 4.2.0,2a – 2.
→ a = 0,0325M
Câu 9:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Công thức của phèn chua hoặc phèn nhôm có dạng: M2SO4.Al2(SO4)3.24H2O
= 0,3.0,18 = 0,054 mol
= 0,78 : 78 = 0,01 mol
Vì > 3., nên đã có phản ứng hòa tan 1 phần kết tủa
Đặt số mol Al3+ trong phèn là x mol
Phương trình phản ứng:
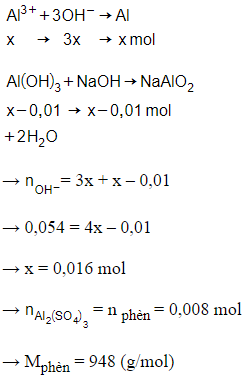
Suy ra M là Kali
Câu 10:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Trong quá trình điện phân, cực dương sẽ bị mòn dần và được hạ thấp dần xuống.
Câu 11:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Ta dùng NaOH để phân biệt ba hỗn hợp chất rắn
- Hỗn hợp có 1 phẩn chất tan ra và có hiện tượng sủi bọt khí → X (Fe, Al)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
- Hỗn hợp tan hết và có hiện tượng sủi bọt khí → Y (Al, Al2O3)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Hỗn hợp có một phần tan, không có sủi bọt khí → Z (Fe, Al2O3)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Câu 12:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Rubi; saphia và boxit đều chứa Al2O3; còn đôlômit có thành phần chính là CaCO3.MgCO3.
Câu 13:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Vhc = πR3 → bán kính giảm 2 lần thì thể tích giảm 8 lần → lượng Al đã phản ứng bằng lượng Al ban đầu.
Câu 14:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Thêm 1,62 gam nhôm vào dung dịch HNO3 thấy khối lượng dung dịch tăng 1,62 gam
→ phản ứng tạo muối NH4NO3
Các muối trong dung dịch gồm Al(NO3)3 và NH4NO3 (0,0225 mol)
Bảo toàn electron:
3.nAl = 8.
→ 3.0,06 = 8.
→ = 0,225 mol =
→ m =
= 213.0,06 + 80.0,0225 = 14,58 gam
Câu 15:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Sơ đồ phản ứng
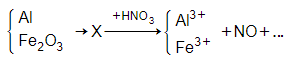
→ Chỉ có Al thay đổi số oxi hóa trong quá trình. Bảo toàn electron ta có:
ne nhường = ne nhận
→ 3nAl = 3nNO
→ nAl = nNO = 0,06 mol
→ mAl = 1,62g
Câu 16:
21/07/2024Cho sơ đồ phản ứng sau:
Al → X → Al2O3 → Y → Z → Al(OH)3
X, Y, Z lần lượt có thể là
 Xem đáp án
Xem đáp án
Đáp án A
Phương trình phản ứng xảy ra lần lượt như sau: (mỗi mũi tên ứng với một phương trình)
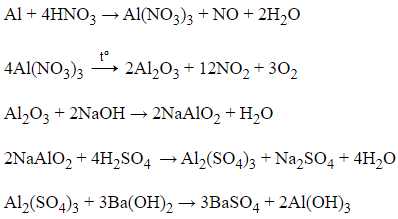
Câu 17:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Khi cho dung dịch HCl đến dư vào dung dịch Na[Al(OH)4] ta có các phương trình:
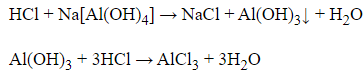
→ Hiện tượng xảy ra là ban đầu xuất hiện kết tủa keo trắng, sau một thời gian kết tủa tan dần
Câu 18:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Cho sản phẩm sau phản ứng hoàn toàn tác dụng với dung dịch NaOH dư thu được khí H2
→ Al còn dư sau phản ứng nhiệt nhôm
→ Tính toán theo số mol Fe2O3
Phương trình hóa học:
Ta có:
→ nAl ban đầu = nAl phản ứng + nAl dư
= 0,02 + 0,02 = 0,04 mol
→ m = 0,04.27 = 1,08 gam
Câu 19:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Những vật làm bằng nhôm có một lớp oxit Al2O3 rất mỏng, bền và mịn, ngăn không cho nước và khí thấm qua, còn màng Al(OH)3 xuất hiện khi Al tác dụng với nước ngăn cản nhôm tiếp xúc với nước
Câu 20:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Ta có:
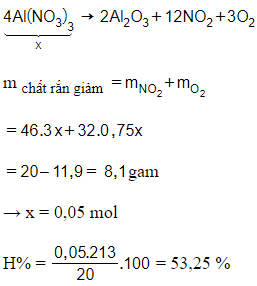
Câu 21:
17/07/2024Thành phần hóa học chính của quặng boxit là
 Xem đáp án
Xem đáp án
Đáp án A
Quặng boxit: Al2O3.2H2O
Câu 22:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
nAl = = 0,1 mol
Bảo toàn electron: 3.nAl = 2.
→ 3.0,1 = 2.
→ = 0,15 mol
→ = 0,15.22,4 = 3,36 lít
Câu 23:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
- Cho hỗn hợp qua dung dịch NaOH dư, Al2O3 tan hết trong dung dịch, Fe2O3 không tan
Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Dẫn khí CO2 qua dung dịch vừa thu được
NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3
- Nung nóng Al(OH)3
2Al(OH)3 Al2O3 + 3H2O
→ thu được Al2O3
Câu 24:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
nAl = = 0,1 mol
Bảo toàn electron: 3.nAl = 3.nNO
→ 3.0,1 = 3. nNO
→ nNO = 0,1 mol
→ = 0,1.22,4 = 2,24 lít
Câu 25:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Al có thể tác dụng được với dung dịch axit và dung dịch bazơ
Al không phản ứng được với dung dịch BaCl2
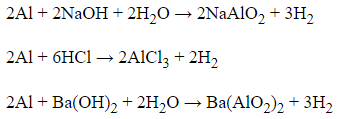
Câu 26:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
2Al + Fe2O3 Al2O3 + 2Fe
→ Kim loại X là nhôm (Al)
Câu 27:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
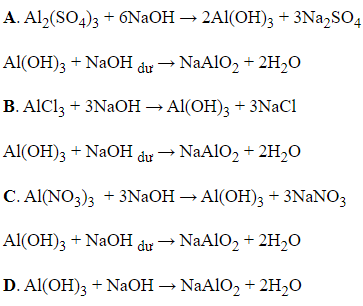
→ Al(OH)3 phản ứng với NaOH theo tỉ lệ mol 1 : 1 cho sản phẩm NaAlO2
Câu 28:
17/07/2024Cho các phát biểu sau:
(a) Nước cứng là nước có nhiều ion Ca2+ và Ba2+.
(b) Cho dung dịch HCl vào dung dịch K2CrO4 thì dung dịch chuyển từ màu da cam sang màu vàng.
(c) Hỗn hợp tecmit dùng hàn đường ray xe lửa là hỗn hợp gồm Al và Fe2O3.
(d) Al(OH)3, Cr(OH)2, Zn(OH)2 đều là hiđroxit lưỡng tính.
(e) Mg được dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân.
Số phát biểu đúng là:
 Xem đáp án
Xem đáp án
Đáp án C
Chỉ có một phát biểu đúng là c.
(a) Nước cứng là nước chứa nhiều ion Ca2+; Mg2+.
(b) Cho dung dịch HCl vào dung dịch K2CrO4 thì dung dịch chuyển từ màu vàng sang màu da cam.
HCl + 2K2CrO4 (dung dịch màu vàng) → H2O + K2Cr2O7 (dung dịch màu da cam) + 2KCl
(d) Cr(OH)2 không có tính lưỡng tính.
(e) Các kim loại kali và natri dùng làm chất trao đổi nhiệt trong một vài lò phản ứng hạt nhân
Câu 29:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
= = 0,1 mol
Nhiệt phân muối thu được oxit kim loại, NO2, O2
Trong đó:
= 0,1 mol
→ = 0,025 mol
mrắn = m muối -
= m + 6,2 – 46.0,1 – 32.0,025
= m + 0,8
Câu 30:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án D
X phản ứng với NaOH sinh ra H2; phản ứng xảy ra hoàn toàn nên Al dư.
Bảo toàn nguyên tố O:
= 0,1 mol
Bảo toàn electron: 3.nAl dư = 2
→ 3.nAl dư = 2.0,15
→ nAl dư = 0,1 mol
Bảo toàn nguyên tố Al và Na
→ + nAl dư
→ nNaOH = 2.0,1 + 0,1 = 0,3 mol
→ VNaOH = 0,3 lít = 300 ml
Có thể bạn quan tâm
- Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm (có đáp án) (583 lượt thi)
- 14 Câu trắc nghiệm luyện tập tính chất của nhôm và hợp chất của nhôm có đáp án (259 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của nhôm và hợp chất của nhôm có đáp án (Nhận biết) (231 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của nhôm và hợp chất của nhôm có đáp án (Thông hiểu) (221 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của nhôm và hợp chất của nhôm có đáp án (Vận dụng) (243 lượt thi)
Các bài thi hot trong chương
- Trắc nghiệm Kim loại kiềm và hợp chất của kim loại kiềm (có đáp án) (1191 lượt thi)
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm cơ bản (959 lượt thi)
- 100 câu trắc nghiệm Kim loại kiềm, Kiềm thổ, Nhôm nâng cao (909 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm (có đáp án) (512 lượt thi)
- Trắc nghiệm Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ (có đáp án) (490 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (Thông hiểu) (332 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án (Nhận biết) (328 lượt thi)
- Trắc nghiệm Kim loại kiềm thổ có đáp án (Nhận biết) (309 lượt thi)
- Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án (Vận dụng) (309 lượt thi)
- Trắc nghiệm Kim loại kiềm và hợp chất quan trọng của kim loại kiềm có đáp án (Nhận biết) (307 lượt thi)