Trắc nghiệm Hóa học 10 Bài 13. Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học có đáp án
Trắc nghiệm Hóa học 10 Bài 13. Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học có đáp án
-
1820 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
20/07/2024Cho các phát biểu sau
(1) Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường.
(2) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
(3) Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
(4) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường.
Các phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các phát biểu đúng là
(1) Phản ứng tỏa nhiệt là phản ứng hóa học trong đó có sự giải phóng nhiệt năng ra môi trường.
(2) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
Câu 2:
19/07/2024Phản ứng nào trong các phản ứng dưới đây là phản ứng thu nhiệt?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Vôi sống tác dụng với nước: CaO + H2O ⟶ Ca(OH)2 phản ứng xảy ra ở điều kiện thường và làm nhiệt độ môi trường xung quanh nóng lên ⇒ Phản ứng tỏa nhiệt.
Đốt cháy than: C + O2 CO2 và đốt cháy cồn: C2H5OH + 3O2
CO2 và đốt cháy cồn: C2H5OH + 3O2 2CO2 + 3H2O cần cung cấp nhiệt độ ban đầu sau đó phản ứng tự cháy và tỏa nhiệt. ⇒ Phản ứng tỏa nhiệt.
2CO2 + 3H2O cần cung cấp nhiệt độ ban đầu sau đó phản ứng tự cháy và tỏa nhiệt. ⇒ Phản ứng tỏa nhiệt.
Nung đá vôi: CaCO3 CaO + CO2 phản ứng cần cung cấp nhiệt độ trong toàn bộ quá trình, nếu ngừng cung cấp nhiệt phản ứng không xảy ra. ⇒ Phản ứng thu nhiệt.
CaO + CO2 phản ứng cần cung cấp nhiệt độ trong toàn bộ quá trình, nếu ngừng cung cấp nhiệt phản ứng không xảy ra. ⇒ Phản ứng thu nhiệt.
Câu 3:
21/07/2024Điều kiện chuẩn là điều kiện ứng với
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Điều kiện chuẩn là điều kiện ứng với 1 bar (đối với chất khí); nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25° C (298 K).
Câu 4:
12/07/2024Nhiệt kèm theo phản ứng trong điều kiện chuẩn là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nhiệt kèm theo phản ứng trong điều kiện chuẩn là biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là 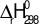 .
.
Câu 5:
23/07/2024Phương trình nhiệt hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu và sản phẩm.
Câu 6:
03/11/2024Cho 2 phương trình nhiệt hóa học sau:
C (s) + H2O (g)  CO (g) + H2 (g)
CO (g) + H2 (g) 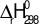 = + 131,25 kJ (1)
= + 131,25 kJ (1)
CuSO4 (aq) + Zn (s)  ZnSO4 (aq) + Cu (s)
ZnSO4 (aq) + Cu (s) 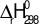 = −231,04 kJ (2)
= −231,04 kJ (2)
Khẳng định đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
*Lời giải
Phản ứng (1) có 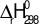 = + 131,25 kJ > 0 nên đây là phản ứng thu nhiệt.
= + 131,25 kJ > 0 nên đây là phản ứng thu nhiệt.
Phản ứng (2) có 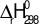 = −231,04 kJ < 0 nên đây là phản ứng tỏa nhiệt.
= −231,04 kJ < 0 nên đây là phản ứng tỏa nhiệt.
*Phương pháp giải
- xem lại điều kiện của phản ứng thu nhiệt và tỏa nhiệt dựa trên biến thiên enthalphy chuẩn
*Lý thuyến cần nắm về enthalphy tạo thành và biến thiên enthalphy :
I. Phản ứng tỏa nhiệt
- Phản ứng tỏa nhiệt là phản ứng có sự giải phóng nhiệt năng ra môi trường.
- Ví dụ:
+ Phản ứng nhiệt nhôm tỏa một lượng nhiệt rất lớn làm nóng chảy hỗn hợp chất phản ứng và sắt sinh ra. Ứng dụng để hàn đường ray
2Al + Fe2O3 t°→→t°Al2O3 + 2Fe
+ Phản ứng đốt cháy than tỏa một lượng nhiệt lớn giúp nấu chín thức ăn và sưởi ấm.
C + O2 t°→ CO2
II. Phản ứng thu nhiệt
- Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
Ví dụ: Phản ứng nung đá vôi là phản ứng thu nhiệt:
CaCO3(s) t°→ CaO(s) + CO2(g)
Nếu ngừng cung cấp nhiệt thì phản ứng sẽ không tiếp tục xảy ra.
Biến thiên enthalpy chuẩn của phản ứng
1. Biến thiên enthalpy của phản ứng
- Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu là ∆rH, thường tính theo đơn vị kJ hoặc kcal.
- Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp (áp suất không đổi).
- Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hóa học, được kí hiệu ΔrHo298, là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn.
- Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/ L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K).
2. Phương trình nhiệt hóa học
- Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (sp).
- Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì ΔrHo298>0.
- Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì ΔrHo298<0
Xem thêm các bài viết liên quan hay, chi tiết:
Lý thuyết Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học – Hóa 10 Chân trời sáng tạo
Bài tập Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học có đáp án
Câu 7:
22/07/2024Enthalpy tạo thành của một chất (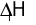 ) là nhiệt kèm theo phản ứng tạo thành
) là nhiệt kèm theo phản ứng tạo thành
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Enthalpy tạo thành của một chất (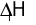 ) là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
) là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
Câu 8:
22/07/2024Cho phản ứng sau:
S (s) + O2 (g)  SO2 (g)
SO2 (g)  (SO2, g) = – 296,8 kJ/mol
(SO2, g) = – 296,8 kJ/mol
Khẳng định sai là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
 (SO2, g) = – 296,8 kJ/mol < 0 nên hợp chất SO2</>
(SO2, g) = – 296,8 kJ/mol < 0 nên hợp chất SO2</>
(g) bền hơn về mặt năng lượng so với các đơn chất bền S (s) và O2 (g).
Do đó khẳng định D sai.
Câu 9:
20/07/2024Cho  (Fe2O3, s) = − 825,5 kJ/mol. Biết 1 J = 0,239 cal. Enthalpy tạo thành chuẩn theo đơn vị (kcal) của Fe2O3 (s) là
(Fe2O3, s) = − 825,5 kJ/mol. Biết 1 J = 0,239 cal. Enthalpy tạo thành chuẩn theo đơn vị (kcal) của Fe2O3 (s) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
1 J = 0,239 cal nên 1 kJ = 0,239 kcal
 (Fe2O3, s) = − 825,5.0,239 = − 197,2945 (kJ/mol).
(Fe2O3, s) = − 825,5.0,239 = − 197,2945 (kJ/mol).
Câu 10:
21/07/2024Cho phản ứng: Na (s) +  Cl2 (g) ⟶NaCl (s) có
Cl2 (g) ⟶NaCl (s) có  (NaCl, s) = − 411,1 kJ/mol.
(NaCl, s) = − 411,1 kJ/mol.
Nếu chỉ thu được 0,5 mol NaCl (s) ở điều kiện chuẩn thì lượng nhiệt tỏa ra là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Enthalpy tạo thành chuẩn của một chất ( ) là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
) là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
Na (s) +  Cl2 (g) ⟶ NaCl (s) có
Cl2 (g) ⟶ NaCl (s) có  (NaCl, s) = − 411,1 kJ/mol
(NaCl, s) = − 411,1 kJ/mol
Nếu tạo thành 1 mol NaCl (s) thì lượng nhiệt tỏa ra là 411,1 kJ
Vậy nếu tạo thành 0,5 mol NaCl (s) thì lượng nhiệt tỏa ra là 411,1.0,5 = 205,55 (kJ)
Câu 11:
23/07/2024Cho phản ứng: N2 (g) + 3H2 (g) ⟶ 2NH3 (g)
Ở điều kiện chuẩn, cứ 1 mol N2 phản ứng hết sẽ tỏa ra 91,8 kJ. Enthalpy tạo thành chuẩn của NH3 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
N2 (g) + 3H2 (g) ⟶ 2NH3 (g)
Ta có, cứ 1 mol N2 phản ứng hết sẽ tỏa ra 91,8 kJ và tạo thành 2 mol NH3
⇒ cứ 0,5 mol N2 phản ứng hết sẽ tỏa ra 91,8.0,5 = 45,9 (kJ) và tạo thành 1 mol NH3
Mà đây là phản ứng tỏa nhiệt nên  < 0.
< 0.
Vậy enthalpy tạo thành chuẩn của NH3 là  = − 45,9 kJ/mol.
= − 45,9 kJ/mol.
</>
Câu 12:
23/07/2024Cho biết phản ứng tạo thành 2 mol HCl (g) ở điều kiện chuẩn tỏa ra 184,62 kJ:
H2 (g) + Cl2 (g)⟶ 2HCl (g) (*)
Những phát biểu nào dưới đây đúng?
(1) Enthalpy tạo thành chuẩn của HCl (g) là − 184,62 kJ/mol.
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ.
(3) Enthalpy tạo thành chuẩn của HCl (g) là – 92,31 kJ/mol.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
(1) Enthalpy tạo thành chuẩn của HCl (g) là − 184,62 kJ/mol. ⇒ sai vì − 184,62 kJ/mol là nhiệt tạo thành của 2 mol HCl (g).
(2) Biến thiên enthalpy chuẩn của phản ứng (*) là − 184,62 kJ.⇒ đúng vì biến thiên enthalpy chuẩn của phản ứng là lượng nhiệt kèm theo của phản ứng đó trong điều kiện chuẩn mà phản ứng tỏa nhiệt nên 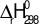 < 0.
< 0.
(3) Enthalpy tạo thành chuẩn của HCl (g) là – 92,31 kJ/mol.⇒ đúng.
(4) Biến thiên enthalpy chuẩn của phản ứng (*) là 184,62 kJ.⇒ sai vì phản ứng tỏa nhiệt nên 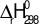 < 0.
< 0.
Câu 13:
23/07/2024Cho các phản ứng dưới đây:
(1) CO (g) +  O2 (g) ⟶ CO2 (g)
O2 (g) ⟶ CO2 (g) 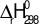 = − 283 kJ
= − 283 kJ
(2) C (s) + H2O (g)  CO (g) + H2 (g)
CO (g) + H2 (g) 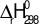 = + 131,25 kJ
= + 131,25 kJ
(3) H2 (g) + F2 (g) ⟶ 2HF (g) 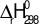 = − 546 kJ
= − 546 kJ
(4) H2 (g) + Cl2 (g)⟶ 2HCl (g) 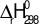 = − 184,62 kJ
= − 184,62 kJ
Phản ứng xảy ra thuận lợi nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phản ứng có 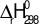 < 0 thường xảy ra thuận lợi hơn.
< 0 thường xảy ra thuận lợi hơn.
Mà phản ứng (3) có 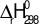 nhỏ nhất nên xảy ra thuận lợi nhất.
nhỏ nhất nên xảy ra thuận lợi nhất.
Câu 14:
14/07/2024Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2 (g) + O2 (g) ⟶ 2NO (g) 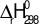 = +180 kJ
= +180 kJ
Kết luận nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
N2 (g) + O2 (g) ⟶ 2NO (g) 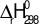 = +180 kJ
= +180 kJ
Ta có: 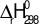 = +180 kJ > 0 nên đây là phản ứng thu nhiệt xảy ra ở nhiệt độ cao. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
= +180 kJ > 0 nên đây là phản ứng thu nhiệt xảy ra ở nhiệt độ cao. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Câu 15:
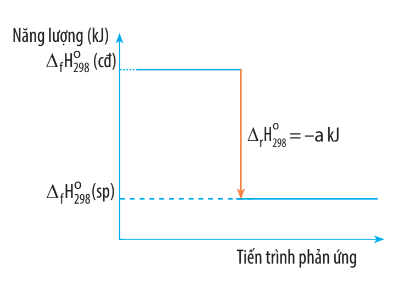
14/07/2024Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Từ sơ đồ ta thấy:  (sp) <
(sp) <  (cđ) nên
(cđ) nên 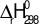 < 0 và
< 0 và 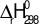 = − a kJ.</></>
= − a kJ.</></>
Do đó đây là phản ứng tỏa nhiệt.
Vậy kết luận A đúng.
Có thể bạn quan tâm
- Trắc nghiệm Hóa học 10 Bài 13. Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học có đáp án (1819 lượt thi)
