Đề thi Học kì 2 Hóa 10 cực hay có đáp án
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 7)
-
829 lượt thi
-
10 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 1:
10/07/20241.Viết phương trình phản ứng chứng minh:
a. Iot có tính oxi hóa yếu hơn clo (1 phương trình phản ứng).
b. Khí sunfurơ làm mất màu dung dịch Br2 (1 phương trình phản ứng).
c. Lưu huỳnh đioxit có tính khử (1 phương trình phản ứng).
d. Trong phản ứng oxi hóa-khử, lưu huỳnh có số oxi hóa tăng từ 0 lên +6 (1 phương trình phản ứng).
2.Viết các phương trình phản ứng trong chuỗi biến hóa sau, ghi rõ điều kiện (nếu có):
KClO3O2S H2S H2SO4Al2(SO4)3AlCl3
 Xem đáp án
Xem đáp án
1. Viết phương trình phản ứng chứng minh
a. Cl2+ 2NaI → 2NaCl + I2
b. SO2+ Br2+ 2H2O →2HBr + H2SO4
c. 5SO2 + 2KMnO4+ 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
d. S + 3F2SF6
2.Phương trình phản ứng
(1) 2KClO32KCl + 3O2
(2) 2H2S + O2 (thiếu)→ 2S + 2H2O
(3) S + H2 H2S
H2S
(4) H2S + 4Cl2+ 4H2O → H2SO4+ 8HCl
(5) 2Al + 6H2SO4→ Al2(SO4)3+ 3SO2+ 6H2O
(6) Al2(SO4)3+ 3BaCl2⟶ 2AlCl3+ 3BaSO4↓
Câu 2:
18/07/20241.Bằng phương pháp hóa học (không dùng chất chỉ thị màu), hãy phân biệt các dung dịch mất nhãn sau:
H2SO4, Na2SO3, AgNO3, HCl.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
1.
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng dung dịch BaCl2
+ Không hiện tượng → HCl
+ Có kết tủa trắng: H2SO4, Na2SO3, AgNO3(nhóm I)
BaCl2+ H2SO4→ BaSO4↓ + 2HCl
BaCl2+ Na2SO3→ BaSO3↓ + 2NaCl
BaCl2+ 2AgNO3→ Ba(NO3)2+ 2AgCl↓
- Lấy HCl vừa nhận ra, cho phản ứng với lần lượt các kết tủa ở trên.
+ Kết tủa tan, có khí thoát ra → kết tủa là BaSO3, chất ban đầu là Na2SO3.
BaSO3+ 2HCl → BaCl2+ SO2↑ + H2O
+ Kết tủa không tan BaSO4; AgCl → nhóm còn lại: H2SO4; AgNO3
- Tiếp tục cho HCl lần lượt vào nhóm còn lại.
+ Có kết tủa trắng → AgNO3.
HCl + AgNO3→ AgCl↓ + HNO3
+ Không hiện tượng → H2SO4.
2.
+ Với dung dịch H2SO4loãng
Fe(OH)2+ H2SO4 → FeSO4+ 2H2O
Fe2O3+ 3H2SO4→ Fe2(SO4)3+ 3H2O
+ Với dung dịch H2SO4đặc, nóng
Cu + 2H2SO4đặc CuSO4 + SO2 + 2H2O
Fe2O3+ 3H2SO4đặc, nóng→ Fe2(SO4)3+ 3H2O
2Fe(OH)2+ 4H2SO4 đặc, nóng→ Fe2(SO4)3 + SO2 + 6H2O
Câu 3:
14/07/2024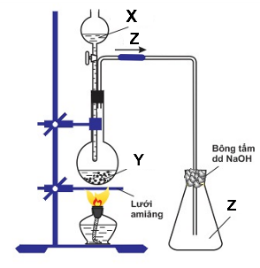 1.Cho sơ đồ thí nghiệm sau:
1.Cho sơ đồ thí nghiệm sau:
Với X, Y, Z là các hợp chất của lưu huỳnh:
+ X có tính oxi hóa mạnh và tính axit mạnh.
+ Y là muối trung hòa của kim loại natri.
+ Z là khí không màu, có mùi hắc.
Nêu hiện tượng và viết phương trình phản ứng xảy ra.
a. Xác định X, Y, Z.
b. Viết phương trình phản ứng xảy ra trong bình cầu.
c. Dẫn khí Z qua ống nghiệm chứa dung dịch axit sunfuhiđric.
Nêu hiện tượng và viết phương trình phản ứng xảy ra.
2. Cho 13 gam Zn dạng hạt vào cốc chứa dung dịch H2SO4 loãng. Ở nhiệt độ phòng, phản ứng xảy ra như sau: Zn + H2SO4 → ZnSO4 + H2
a. Ban đầu nồng độ của H2SO4 là a mol/l. Sau 80 giây, nồng độ của H2SO4 trong dung dịch còn lại là 0,036 mol/l. Biết tốc độ trung bình của phản ứng là 8.10-4 mol/(l.s). Tính a.
b. Nếu giữ nguyên các điều kiện khác, chỉ biến đổi 1 trong các điều kiện sau đây thì tốc độ phản ứng biến đổi như thế nào?
- Thay 13 gam kẽm hạt bằng 13 gam kẽm bột.
- Thực hiện phản ứng ở nhiệt độ thấp hơn (khoảng 20oC).
- Dùng thể tích dung dịch H2SO4 gấp ba lượng ban đầu.
 Xem đáp án
Xem đáp án
1. a. Với X, Y, Z là các hợp chất của lưu huỳnh:
+ X có tính oxi hóa mạnh và tính axit mạnh ⇒ H2SO4
+ Y là muối trung hòa của kim loại natri ⇒Na2SO3
+ Z là khí không màu, có mùi hắc ⇒SO2
b. Na2SO3+ H2SO4Na2SO4 + SO2 + H2O
c. Khi sục SO2vào dung dịch H2S thì xảy ra hiện tượng là dung dịch bị vẩn đục màu vàng (S). PTHH:
SO2+ 2H2S → 3S↓ + 2H2O
2.
- Thay 13 gam kẽm hạt bằng 13 gam kẽm bột.
- Thực hiện phản ứng ở nhiệt độ thấp hơn (khoảng 20oC).
- Dùng thể tích dung dịch H2SO4gấp ba lượng ban đầu.
a. Ta có
b.
- Thay 13 gam kẽm hạt bằng 13 gam kẽm bột thì tốc độ phản ứng tăng lên do tăng diện tích bề mặt. Kẽm bột phản ứng với axit nhanh hơn kẽm hạt.
- Thực hiện phản ứng ở nhiệt độ thấp hơn (khoảng 20oC) thì tốc độ phản ứng giảm xuống (chậm đi) do giảm nhiệt độ.
- Dùng thể tích dung dịch H2SO4gấp ba lượng ban đầu thì tốc độ phản ứng không thay đổi vì thể tích không ảnh hưởng đến tốc độ phản ứng.
Câu 4:
19/07/2024Hấp thụ hoàn toàn 3,36 lít khí SO2(đktc) bằng 200 gam dung dịch KOH 7%, thu được dung dịch A. Tính nồng độ phần trăm các chất tan trong dung dịch A.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
⇒ Tạo muối K2SO3và KHSO3
Đặt số mol K2SO3và KHSO3lần lượt là x và y
Theo bài ra ta có hệ phương trình:
mdd saupư= + mKOH = 0,15.64 + 200 = 209,6g
Câu 5:
20/07/2024Chia 20 gam hỗn hợp A gồm Fe, Cu và CuO thành 2 phần bằng nhau:
- Phần 1: tác dụng vừa đủ với 200 ml dung dịch H2SO40,5M, thu được khí H2.
- Phần 2: tác dụng với 62,5 gam dung dịch H2SO478,4% (lấy dư), đun nóng, thu được dung dịch B và khí SO2(sản phẩm khử duy nhất). Cô cạn dung dịch B thu được 26 gam muối khan.
a. Tính phần trăm khối lượng mỗi chất trong hỗn hợp A.
b. Lượng axit dư trong dung dịch B có thể hòa tan tối đa 2,4 gam kim loại M (hóa trị II), thu được khí SO2 (sản phẩm khử duy nhất). Xác định tên kim loại M.
c. Hấp thụ hoàn toàn lượng khí SO2 ở phần 2 bằng một lượng vừa đủ dung dịch Br2 thu được dung dịch X. Trung hòa dung dịch X cần dùng bao nhiêu gam dung dịch NaOH 25%?
 Xem đáp án
Xem đáp án
Gọi số mol của Fe, Cu và CuO lần lượt là x (mol), y (mol), z (mol).
Phần 1:
Vì phản ứng tạo ra khí H2nên dung dịch H2SO4 loãng ⇒ Chỉ có Fe và CuO phản ứng. Ta có PTHH
Fe + H2SO4→ FeSO4+ H2
x x x
CuO + H2SO4→ CuSO4+ H2O
y y
Theo phương tình ta có: x + z = 0,1 (1)
Phần 2:
Vì phản ứng tạo khí SO2nên dung dịch H2SO4đặc ⇒ Có Fe, Cu và CuO phản ứng.
Ta có PTHH
2Fe + 6H2SO4→ Fe2(SO4)3+ 3SO2+ 6H2O
x
Cu + 2H2SO4→ CuSO4+ SO2+ 2H2O
y y
CuO + H2SO4→ CuSO4+ H2O
z z
Cô cạn dụng dịch được 26 gam muối khan.
⇒ 200x + 160y + 160z = 26 gam ( 2)
Ta có: 56x + 64y + 80z = 10 gam (3)
Từ (1), (2) và (3) ta có hệ phương trình:
a.
b.
= 0,5 – ( 3.0,05 + 2.0,05 + 0,05) = 0,2 mol
M + 2H2SO4→ MSO4+ SO2+ 2H2O
 nM= 0,1 mol
nM= 0,1 mol  M = = 24
M = = 24 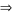 M là Mg
M là Mg
c.
= .0,05 + 0,05 = 0,125 mol
SO2+ Br2+ 2H2O → H2SO4+ 2HBr
0,125 →0,1250,25
2NaOH + H2SO4→ Na2SO4+ 2H2O
NaOH + HBr → NaBr + H2O
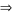 nNaOH= 0,125.2 + 0,25 = 0,5 mol
nNaOH= 0,125.2 + 0,25 = 0,5 mol
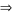 mddNaOH= = 80 gam
mddNaOH= = 80 gam
Câu 6:
13/07/20241.Viết phương trình phản ứng chứng minh:
a. Ozon có tính oxi hóa mạnh hơn oxi (1 phương trình phản ứng).
b. Khí hiđro sunfua làm mất màu dung dịch Br2 (1 phương trình phản ứng).
c. Lưu huỳnh đioxit có tính oxi hóa (1 phương trình phản ứng).
d. Trong phản ứng oxi hóa-khử, lưu huỳnh có số oxi hóa giảm từ +6 về +4 (1 phương trình phản ứng).
2.Viết các phương trình phản ứng trong chuỗi biến hóa sau, ghi rõ điều kiện (nếu có):
FeS2SO2S H2S SO2H2SO4Al2(SO4)3
 Xem đáp án
Xem đáp án
1.
a. 2Ag + O3 → Ag2O + O2
b. H2S + 4Br2+ 4H2O → H2SO4+ 8HBr
c. SO2 + 2H2S → 2H2O + 3S
d. 2Al + 6H2SO4→ Al2(SO4)3+ 3SO2+ 6H2O
2. Phương trình phản ứng
(1) 4FeS2+ 11O22Fe2O3+ 8SO2
(2) SO2 + 2H2S → 2H2O + 3S
(3) S + H2H2S
(4) 2H2S + 3O2 dư 2H2O + 2SO2
(5) SO2 + Br2+ 2H2O → 2HBr + H2SO4
(6) 2Al + 6H2SO4→ Al2(SO4)3+ 3SO2+ 6H2O
Câu 7:
07/07/20241.Bằng phương pháp hóa học (không dùng chất chỉ thị màu), hãy phân biệt các dung dịch mất nhãn sau:
H2SO4, K2S, Na2SO4, HCl.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
|
Chất thử |
H2SO4 |
Na2SO4 |
K2S |
HCl |
|
HCl |
x |
x |
Sủi bọt khí có mùi trứng thối (H2S↑) |
x |
|
Na2CO3 |
Sủi bọt khí (CO2↑) |
x |
- |
Sủi bọt khí (CO2↑) |
|
BaCl2 |
Xuất hiện kết tủa trắng (BaSO4↓) |
– |
– |
x |
Phương trình hoá học:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho dung dịch HCl vào 4 ống nghiệm nếu thấy ống nghiệm nào sủi bọt khí có mùi trứng thối (H2S↑) thì ống đó chứa dung dịch K2S.
K2S + 2HCl → 2KCl + H2S↑
Còn lại không có hiện tượng gì xuất hiện là: H2SO4, Na2SO4, HCl (nhóm I)
- Cho dung dịch Na2CO3 vào từng mẫu thử nhóm I. Nếu ống nghiệm vào có sủi bọt khí (CO2↑) thì ống đó chứa H2SO4và HCl. Ống còn lại không hiện tượng là Na2SO4.
H2SO4+ Na2CO3 → Na2SO4+ CO2↑+ H2O
2HCl + Na2CO3 → 2NaCl + CO2↑+ H2O
- Để phân biệt dung dịch H2SO4và HCl ta dùng BaCl2. Nếu ống nghiệm nào xuất hiện kết tủa trắng( BaSO4↓) thì ống đó chứa dung dịch H2SO4.
BaCl2+ H2SO4 → BaSO4 (↓ trắng) + 2HCl
2.
+ Với H2SO4loãng
FeO + H2SO4 → FeSO4+ H2O
H2SO4+ K2CO3 → K2SO4+ CO2↑+ H2O
+ Với H2SO4đặc, nóng
Cu + 2H2SO4đặc CuSO4 + SO2 + 2H2O
2FeO + 4H2SO4 đặc, nóng→ Fe2(SO4)3 + SO2 + 4H2O
Câu 8:
16/07/20241.Cho sơ đồ thí nghiệm sau:
 Với X, Y, Z là các hợp chất của lưu huỳnh:
Với X, Y, Z là các hợp chất của lưu huỳnh:
+ X có tính oxi hóa mạnh và tính axit mạnh.
+ Y là muối trung hòa của kim loại natri.
+ Z là khí không màu, có mùi hắc.
a. Xác định X, Y, Z.
b. Viết phương trình phản ứng xảy ra trong bình cầu.
c. Dẫn khí Z qua ống nghiệm chứa dung dịch axit sunfuhiđric.
Nêu hiện tượng và viết phương trình phản ứng xảy ra.
2.Cho 26 gam Zn dạng hạt vào cốc chứa dung dịch H2SO4loãng. Ở nhiệt độ phòng, phản ứng xảy ra như sau: Zn + H2SO4→ ZnSO4+ H2
a. Ban đầu nồng độ của H2SO4là 0,22 mol/l. Sau 160 giây, nồng độ của H2SO4trong dung dịch còn lại là a mol/l. Biết tốc độ trung bình của phản ứng là 7,5.10-4mol/(l.s). Tính a.
b. Nếu giữ nguyên các điều kiện khác, chỉ biến đổi 1 trong các điều kiện sau đây thì tốc độ phản ứng biến đổi như thế nào?
- Thay 26 gam kẽm hạt bằng 26 gam kẽm bột.
- Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 60oC).
- Dùng thể tích dung dịch H2SO4gấp đôi lượng ban đầu.
 Xem đáp án
Xem đáp án
a. Với X, Y, Z là các hợp chất của lưu huỳnh:
+ X có tính oxi hóa mạnh và tính axit mạnh ⇒ H2SO4
+ Y là muối trung hòa của kim loại natri ⇒Na2SO3
+ Z là khí không màu, có mùi hắc ⇒SO2
b. Na2SO3+ H2SO4Na2SO4 + SO2 + H2O
c. Khi sục SO2vào dung dịch H2S thì xảy ra hiện tượng là dung dịch bị vẩn đục màu vàng (S). PTHH:
SO2+ 2H2S → 3S↓ + 2H2O
2.
a. Ta có
b.
- Thay 26 gam kẽm hạt bằng 26 gam kẽm bột thì tốc độ phản ứng tăng lên do tăng diện tích bề mặt. Kẽm bột phản ứng với axit nhanh hơn kẽm hạt.
- Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 60oC) thì tốc độ phản ứng tăng lên do tăng nhiệt độ.
- Dùng thể tích dung dịch H2SO4gấp đôi lượng ban đầu thì tốc độ phản ứng không thay đổi vì thể tích không ảnh hưởng đến tốc độ phản ứng.
Câu 9:
15/07/2024Hấp thụ hoàn toàn 4,48 lít khí SO2(đktc) bằng 160 gam dung dịch NaOH 7,5%, thu được dung dịch A. Tính nồng độ phần trăm các chất tan trong dung dịch A.
 Xem đáp án
Xem đáp án
Đáp án đúng là:
⇒ Tạo muối Na2SO3và NaHSO3
Đặt số mol Na2SO3và NaHSO3lần lượt là x và y
Theo bài ra ta có hệ phương trình:
mdd sau pư = + mNaOH = 0,2.64 + 160 = 172,8g
Câu 10:
18/07/2024Chia 16 gam hỗn hợp A gồm Fe, Cu và CuO thành 2 phần bằng nhau:
- Phần 1: tác dụng vừa đủ với 150 ml dung dịch H2SO40,5M, thu được khí H2.
- Phần 2: tác dụng với 49 gam dung dịch H2SO475% (lấy dư), đun nóng, thu được dung dịch B và khí SO2(sản phẩm khử duy nhất). Cô cạn dung dịch B thu được 22 gam muối khan.
a. Tính phần trăm khối lượng mỗi chất trong hỗn hợp A.
b. Lượng axit dư trong dung dịch B có thể hòa tan tối đa 3,25 gam kim loại M (hóa trị II), thu được khí SO2 (sản phẩm khử duy nhất). Xác định tên kim loại M.
c. Hấp thụ hoàn toàn lượng khí SO2 ở phần 2 bằng một lượng vừa đủ dung dịch Br2 thu được dung dịch X. Trung hòa dung dịch X cần dùng bao nhiêu gam dung dịch KOH 28%?
 Xem đáp án
Xem đáp án
Gọi số mol của Fe, Cu và CuO lần lượt là x (mol), y (mol), z (mol).
Phần 1:
Vì phản ứng tạo ra khí H2nên dung dịch H2SO4loãng ⇒ Chỉ có Fe và CuO phản ứng. Ta có PTHH
Fe + H2SO4→ FeSO4+ H2
x x
CuO + H2SO4→ CuSO4+ H2O
y y
Theo phương tình ta có: x + z = 0,075 (1)
Phần 2:
Vì phản ứng tạo khí SO2nên dung dịch H2SO4 đặc ⇒ Có Fe, Cu và CuO phản ứng. Ta có PTHH
2Fe + 6H2SO4→ Fe2(SO4)3+ 3SO2+ 6H2O
x
Cu + 2H2SO4→ CuSO4+ SO2+ 2H2O
y y
CuO + H2SO4→ CuSO4+ H2O
z z
Cô cạn dụng dịch được 26 gam muối khan.
⇒ 200x + 160y + 160z = 22 gam ( 2)
Ta có: 56x + 64y + 80z = 10 gam (3)
Từ (1), (2) và (3) ta có hệ phương trình:
a.
b.
= 0,375 – ( 3.0,05 + 2.0,05 + 0,025) = 0,1 mol
M + 2H2SO4→ MSO4+ SO2+ 2H2O
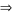 nM= 0,05 mol
nM= 0,05 mol 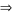 M = = 65
M = = 65 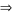 M là Zn
M là Zn
c.
= .0,05 + 0,05 = 0,125 mol
SO2+ Br2+ 2H2O → H2SO4+ 2HBr
0,125 →0,1250,25
2KOH + H2SO4→ K2SO4+ 2H2O
KOH + HBr → KBr + H2O
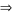 nKOH= 0,125.2 + 0,25 = 0,5 mol
nKOH= 0,125.2 + 0,25 = 0,5 mol
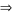 mddKOH= = 100 gam
mddKOH= = 100 gam
Bài thi liên quan
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 1)
-
20 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 2)
-
23 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 3)
-
19 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 4)
-
19 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 5)
-
40 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 6)
-
7 câu hỏi
-
45 phút
-
Có thể bạn quan tâm
- Đề thi Học kì 2 Hóa 10 cực hay có đáp án (828 lượt thi)
- Đề thi giữa kì 2 Hóa 10 cực hay có đáp án (395 lượt thi)
- Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (3252 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 1) (609 lượt thi)
- Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận (674 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 1) (866 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 2) (1270 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 2) (685 lượt thi)
- Đề thi Hóa 10 Học kì 2 (Bài kiểm tra học kì) (655 lượt thi)
Các bài thi hot trong chương
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1) (2600 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 1) (757 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2) (735 lượt thi)
- Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 2 - Đề 1) (618 lượt thi)
- Đề thi Hóa 10 Học kì 1 (557 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (503 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 biên soạn (446 lượt thi)
- Đề thi Học kì 1 Hóa 10 có đáp án (328 lượt thi)
- Đề thi giữa kì 1 Hóa 10 cực hay có đáp án (Bài kiểm tra số 2) (306 lượt thi)
