Đề thi Học kì 2 Hóa 10 cực hay có đáp án
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 5)
-
830 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
14/07/2024Cho các cặp chất sau:
(1) Khí F2và khí O2.
(2) Khí H2S và dung dịch FeCl3.
(3) Khí H2S và dung dịch Pb(NO3)2.
(4) CuS và cặp dung dịch HCl.
(5) Dung dịch AgNO3và dung dịch FeCl3.
(6) Dung dịch KMnO4và khí SO2.
(7) Hg và S.
Số cặp chất xảy ra phản ứng hóa học ở nhiệt độ thường là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số cặp chất xảy ra phản ứng hóa học ở nhiệt độ thường là: (2); (3); (5); (6); (7).
Loại cặp (1) vì F2không phản ứng trực tiếp với O2.
Loại cặp (4) vì CuS không phản ứng với HCl.
Câu 2:
17/07/2024Để nhận ra sự có mặt của ion sunfat trong dung dịch, người ta thường dùng
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Để nhận ra sự có mặt của ion sunfat trong dung dịch, người ta thường dùng dung dịch chứa ion Ba2+như BaCl2, Ba(OH)2, ... vì tạo kết tủa trắng BaSO4
Ví dụ:
BaCl2+ Na2SO4→ BaSO4↓ + 2NaCl
Câu 3:
22/07/2024Hấp thụ hoàn toàn 5,6 lít khí SO2(đktc) vào 400 ml dung dịch NaOH 1M. Khối lượng muối thu được sau phản ứng là: (Cho Na = 23; S = 32; O = 16; H = 1)
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số mol SO2là: \({n_{S{O_2}}} = \frac{{5,6}}{{22,4}}\) = 0,25 mol
Số mol NaOH là: nNaOH= 0,4.1 = 0,4 mol
Xét \(T = \frac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = \frac{{0,4}}{{0,25}} = 1,6\) < 2
Suy ra phản ứng tạo 2 muối:
Suy ra \(\left\{ {\begin{array}{*{20}{c}}{a + b = 0,25}\\{2a + b = 0,4}\end{array}} \right.\) → a = 0,15; b = 0,1
Vậy khối lượng muối thu được sau phản ứng là:
mmuối= 0,15.126 + 0,1.104 = 29,3 g.
Câu 4:
21/07/2024Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Vì S trong phân tử SO2có số oxi hóa là: +4 (số oxi hóa trung gian) nên có thể:
+ Nhường đi e để lên số oxi hóa cao hơn +6 (tính khử).
+ Nhận thêm e để xuống số oxi hóa thấp hơn (0, -2) (tính oxi hóa).
Câu 5:
17/07/2024Các nguyên tố thuộc nhóm oxi - lưu huỳnh có bao nhiêu electron ở phân lớp ngoài cùng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các nguyên tố thuộc nhóm oxi - lưu huỳnh có phân lớp ngoài cùng là np4.
Vậy có 4 electron ở phân lớp ngoài cùng.
Câu 6:
23/07/2024Liên kết trong các phân tử đơn chất halogen là gì?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết trong phân tử của các đơn chất halogen là liên kết cộng hóa trị không cực.
Câu 7:
20/07/2024Anion X2-có cấu hình electron lớp ngoài cùng là 2s22p6. Nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình e của X2-là: 1s22s22p6
X2-là anion do X được nhận 2 e tạo thành.
Suy ra cấu hình electron của X là: 1s22s22p4.
Vậy nguyên tố X là O.
Câu 8:
15/07/2024Cho FeS tác dụng với dung dịch HCl, khí bay ra là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
FeS + 2HCl → FeCl2+ H2S↑
Câu 9:
22/07/2024Khi sục SO2vào dung dịch NaOH theo tỉ lệ \(\frac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = 2\) thu được dung dịch
gồm các chất
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khi sục SO2vào dung dịch NaOH theo tỉ lệ \(\frac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = 2\) thu được dung dịch là:
Na2SO3.
Phương trình hóa học: SO2+ 2NaOH → Na2SO3+ H2O
Câu 10:
06/07/2024Trong các nguyên tử nguyên tố nhóm halogen, chất ở trạng thái khí màu lục nhạt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Flo ở dạng khí và có màu lục nhạt.
Câu 11:
14/07/2024Phần trăm khối lượng của S có trong phân tử Fe2(SO4)3
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
%S =\(\frac{{3.32}}{{400}}.100\% \) = 24%.
Câu 12:
23/07/2024Cho 11,2 gam bột Fe tác dụng với dung dịch HCl dư thu được V lít khí H2bay ra (đktc). Thể tích V lít khí thoát ra là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số mol Fe là: nFe= \(\frac{{11,2}}{{56}}\) = 0,2 mol
Phương trình phản ứng:
Vậy \({V_{{H_2}}}\)= 0,2.22,4 = 4,48 lít.\[\]
Câu 13:
10/07/2024Khí oxi không phản ứng được với
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
O2+ 2Cu 2CuO
O2+ S SO2
3Fe + 2O2Fe3O4
Câu 14:
20/07/2024Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3(dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
\({n_{FeC{l_2}}} = \frac{{24,4}}{{127 + 58,5.2}}\)= 0,1 mol → nNaCl= 0,2 mol
Bảo toàn nguyên tố Cl:
nAgCl= 2\({n_{FeC{l_2}}}\)+ nNaCl = 2.0,1 + 0,2 = 0,4 mol
Ta có: Fe2+→ Fe3+ + 1e, Ag+ + 1e → Ag
Vậy m = mAgCl+ mAg= 0,4.143,5 + 0,1.108 = 68,2 g.
Câu 15:
22/07/2024Kim loại không phản ứng với axit H2SO4đặc, nguội là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Kim loại không phản ứng với axit H2SO4đặc nguội là Fe.
Câu 16:
23/07/2024Cho 15,8 gam KMnO4tác dụng hoàn toàn với dung dịch HCl đặc, dư. Thể tích khí thu được (đktc) là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
\({n_{KMn{O_4}}} = \frac{{15,8}}{{158}}\)= 0,1 mol
Phương trình phản ứng:
Vậy \[{V_{C{l_2}}}\]= 0,25.22,4 = 5,6 lít.
Câu 17:
18/07/2024Các số oxi hoá có thể có của S trong hợp chất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các số oxi hóa phổ biến của S trong hợp chất là -2, +4, +6.
Câu 18:
21/07/2024Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
2KMnO4K2MnO4+ MnO2+ O2
Câu 19:
04/07/2024Hoà tan 8,8 gam hỗn hợp X gồm Mg và Cu trong axit H2SO4loãng dư, sau khi phản ứng xảy ra thì thu được 4,48 lít khí H2(đktc). Số gam của Mg và Cu trong hỗn hợp X lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol H2là: \[{n_{{H_2}}} = \frac{{4,48}}{{22,4}}\] = 0,2 mol
Suy ra mMg= 0,2.24 = 4,8 gam, mCu= 8,8 – 4,8 = 4 g.
Câu 20:
15/07/2024Hợp chất của lưu huỳnh có tính tẩy màu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hợp chất của lưu huỳnh có tính tẩy màu là SO2.
Câu 21:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số mol X2 là: = 0,1 mol
Theo phương trình phản ứng ta có = 0,1 mol
Suy ra = = 224 g/mol = 64 + X.2 suy ra X = 80
Vậy X là Br
Câu 22:
20/07/2024Để điều chế SO2trong công nghiệp người ta tiến hành như sau:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A.
Để điều chế SO2trong công nghiệp người ta tiến hành như sau: Đốt cháy S hoặc quặng pirit sắt (FeS2).
S + O2SO2
4FeS2+ 11O22Fe2O3+ 8SO2
Câu 23:
16/07/2024Nhiệt phân hoàn toàn 4,385 gam hỗn hợp X gồm KClO3và KMnO4 thu được O2và m gam hỗn hợp chất rắn. Toàn bộ lượng O2sinh ra tác dụng hết với cacbon nóng đỏ, thu được 0,896 lít hỗn hợp khí có tỉ khối so với hidro là 16. Phần trăm về khối lượng của KMnO4trong hỗn hợp đầu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
C nóng đỏ phản ứng với O2thu được hỗn hợp khí có M = 32
Suy ra 2 khí là CO và CO2với tổng số mol bằng 0,04.
Dùng quy tắc đường chéo được nCO= 0,03 mol; \[{n_{C{O_2}}}\]= 0,01 mol
Bảo toàn electron có: \[{n_{{O_2}}} = \frac{{4.{n_{C{O_2}}} + 2.{n_{CO}}}}{4} = 0,025mol\]
Gọi \[{n_{KCl{O_3}}}\]= x (mol); \[{n_{KMn{O_4}}}\]= y (mol)
Có
\[\left\{ {\begin{array}{*{20}{c}}{1,5x + 0,5y = 0,025}\\{122,5x + 158y = 4,385}\end{array}} \right.\] suy ra x = 0,01; y = 0,02
Vậy \[\% {m_{KMn{O_4}}} = \frac{{0,02.158}}{{4,385}}.100\% \] = 72,06%
Câu 24:
16/07/2024Để pha loãng dd H2SO4đậm đặc, trong phòng thí nghiệm, người ta tiến hành theo cách nào trong các cách sau đây:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
H2SO4tan vô hạn trong nước và tỏa ra rất nhiều nhiệt. Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy, muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh mà không được làm ngược lại.
Câu 25:
21/07/2024Phản ứng mà SO2thể hiện tính khử là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phản ứng mà SO2thể hiện tính khử là: 2SO2+ O2⇄ 2SO3.
Trong phản ứng này, số oxi hóa của S tăng lên sau phản ứng.
Câu 26:
19/07/2024Cấu hình e lớp ngoài cùng của nguyên tử các nguyên tố halogen là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình e lớp ngoài cùng của nguyên tử các nguyên tố halogen là: ns2 np5.
Câu 27:
03/07/2024Phương pháp điều chế khí hidroclorua trong phòng thí nghiệm là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phương pháp điều chế khí hidroclorua trong phòng thí nghiệm là cho NaCl tinh thể phản ứng H2SO4 đặc, đun nóng
NaCl + H2SO4(đặc) NaHSO4+ HCl
Câu 28:
18/07/2024Trong các phản ứng sau, phản ứng nào thể hiện tính oxi hóa của lưu huỳnh đơn chất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phản ứng thể hiện tính oxi hóa của lưu huỳnh đơn chất là:
S + Hg 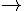 HgS. (\[\mathop S\limits^0 \to \mathop S\limits^{ - 2} \])
HgS. (\[\mathop S\limits^0 \to \mathop S\limits^{ - 2} \])
Câu 29:
12/07/2024Oxi tác dụng với tất cả các chất trong nhóm nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
2Mg + O22MgO
4Al+ 3O22Al2O3
N2+ O22NO
Câu 30:
13/07/2024Cho phương trình phản ứng Cu + H2SO4đ→ CuSO4+ SO2+ H2O.
Hệ số cân bằng tối giản nhất của H2SO4đlà?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cu + 2H2SO4đ → CuSO4+ SO2+ 2H2O.
Câu 31:
22/07/2024Dãy nào sau đây được sắp xếp theo chiều tăng dần của tính phi kim?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Dãy được sắp xếp theo chiều tăng dần của tính phi kim là: I, Br, Cl, F.
Câu 32:
07/07/2024Cho phản ứng: SO2 + Cl2 + 2H2O \( \to \) 2HCl + H2SO4. Clo là chất đóng vai trò chất
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong phản ứng: SO2 + Cl2 + 2H2O \( \to \) 2HCl + H2SO4.
Clo là chất đóng vai trò chất là chất oxi hóa. (\[\mathop {C{l_2}}\limits^0 + 2e \to 2\mathop {Cl}\limits^{ - 1} \]).
Câu 33:
20/07/2024Nhóm kim loại nào sau đây không có phản ứng với H2SO4 loãng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C.
Nhóm kim loại không có phản ứng với H2SO4 loãng là: Cu, Ag.
Do Cu, Ag đứng sau H trong dãy hoạt động hóa học của kim loại.
Câu 34:
14/07/2024Kim loại nào sau đây khi tác dụng với dung dịch HCl và khí clo đều cho cùng một loại muối
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Mg + 2HCl → MgCl2+ H2
Mg + Cl2MgCl2
Câu 35:
19/07/2024Trong phân tử H2S nguyên tử S có
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong phân tử H2S nguyên tử S có số oxi hoá -2 (\[\mathop {{H_2}}\limits^{ + 1} \mathop S\limits^{ - 2} \])
Câu 36:
22/07/2024Phản ứng chứng tỏ ozon có tính oxi hoá mạnh hơn oxi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ozon là một trong số những chất có tính oxi hóa mạnh và mạnh hơn O2.
O2không oxi hóa được Ag, nhưng O3 oxi hóa Ag thàn Ag2O:
2Ag + O3→ Ag2O + O2
Câu 37:
05/07/2024Cho các chất: C, Cu, FeS, FeO, Fe(OH)2, Fe2O3, Fe(OH)3, NaCl rắn. Số chất tác dụng với H2SO4 đ, nóng tạo chất khí là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
C + 2H2SO4 đ, nóng → 2SO2 + CO2 + 2H2O
Cu + 2H2SO4 đ, nóng → CuSO4 + SO2 + 2H2O
2FeS + 10H2SO4 đ, nóng → Fe2(SO4)3 + 9SO2 + 10H2O
2FeO + 4H2SO4 đ, nóng → Fe2(SO4)3 + SO2 + 4H2O
2Fe(OH)2 + 4H2SO4 đ, nóng → Fe2(SO4)3 + SO2 + 6H2O
NaCl rắn + H2SO4 đ, nóng → NaHSO4 + HCl
Câu 38:
23/07/2024Công thức của clorua vôi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức của clorua vôi là: CaOCl2.
Câu 39:
23/07/2024Axit không thể đựng trong bình thủy tinh là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
HF là axi yếu nhưng có tính chất đặc biệt là ăn mòn các đồ vật bằng thủy tinh. Vì vậy HF không thể đựng trong các bình bằng thủy tinh.
4HF + SiO2→ SiF4+ 2H2O
Câu 40:
03/07/2024Cho phản ứng 2Fe(OH)3+ 3H2SO4→ X + 6H2O. Tên X là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
2Fe(OH)3+ 3H2SO4→ Fe2(SO4)3+ 6H2O
X là: Sắt (III) sunfat.
Bài thi liên quan
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 1)
-
20 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 2)
-
23 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 3)
-
19 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 4)
-
19 câu hỏi
-
50 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 6)
-
7 câu hỏi
-
45 phút
-
-
Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 7)
-
10 câu hỏi
-
90 phút
-
Có thể bạn quan tâm
- Đề thi Học kì 2 Hóa 10 cực hay có đáp án (829 lượt thi)
- Đề thi giữa kì 2 Hóa 10 cực hay có đáp án (395 lượt thi)
- Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (3252 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 1) (609 lượt thi)
- Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận (674 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 1) (868 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 2) (1270 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 2) (685 lượt thi)
- Đề thi Hóa 10 Học kì 2 (Bài kiểm tra học kì) (656 lượt thi)
Các bài thi hot trong chương
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1) (2600 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 1) (757 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2) (735 lượt thi)
- Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 2 - Đề 1) (618 lượt thi)
- Đề thi Hóa 10 Học kì 1 (557 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (505 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 biên soạn (446 lượt thi)
- Đề thi Học kì 1 Hóa 10 có đáp án (328 lượt thi)
- Đề thi giữa kì 1 Hóa 10 cực hay có đáp án (Bài kiểm tra số 2) (306 lượt thi)
